
ЎҫМвДҝЎҝПЦУРІҝ·Ц¶МЦЬЖЪФӘЛШөДРФЦК»тФӯЧУҪб№№ИзұнЗТФӯЧУРтКэ°ҙXYTZТАҙОФцҙуЈә
ФӘЛШұаәЕ | ФӘЛШРФЦК»тФӯЧУҪб№№ |
X | ЧоНвІгөзЧУКэКЗҙОНвІгөзЧУКэөД2ұ¶ |
Y | іЈОВПВөҘЦКОӘЛ«ФӯЧУ·ЦЧУЈ¬ЖдЗв»ҜОпЛ®ИЬТәіКјоРФ |
T | ЧоНвІгөзЧУКэКЗөзЧУІгКэөД2ұ¶ |
Z | ФӘЛШЧоёЯХэјЫКЗ+7јЫ |
ЈЁ1Ј©ЛДЦЦФӘЛШФӯЧУ°лҫ¶УЙҙуөҪРЎөДЛіРтКЗЈЁРҙФӘЛШ·ыәЕЈ© Ј®
ЈЁ2Ј©ФӘЛШYУлЗвФӘЛШРОіЙөДТ»ЦЦАлЧУYH4+ Ј¬ РҙіцёГОўБЈөДөзЧУКҪЈЁУГФӘЛШ·ыәЕұнКҫЈ©Ј®
ЈЁ3Ј©TФӘЛШөДјтөҘТхАлЧУөДҪб№№КҫТвНјКЗ Ј¬
ЈЁ4Ј©ЦӨГчёГБЈЧУөД»№ФӯРФұИZ©ҒЗҝөДАлЧУ·ҪіМКҪКЗ Ј®
ЈЁ5Ј©ФӘЛШZөДөҘЦКУлЗвСх»ҜДЖИЬТә·ҙУҰөД»ҜС§·ҪіМКҪОӘ Ј®
ЈЁ6Ј©Ҫ«9gөҘЦКXФЪЧгБҝСхЖшЦРИјЙХЈ¬ЛщөГЖшМеНЁИл1L 1molL©Ғ1NaOHИЬТәЦРЈ¬НкИ«ОьКХәуЈ¬Ҫ«ИЬТәФЪјхС№өНОВМхјюПВХфёЙЈ¬өГөҪІ»ә¬Ҫбҫ§Л®өД№ММеЦКБҝОӘgЈ®
Ўҫҙр°ёЎҝ
ЈЁ1Ј©SЈҫClЈҫCЈҫN
ЈЁ2Ј©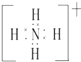
ЈЁ3Ј©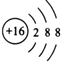
ЈЁ4Ј©Cl2+S2©Ғ=S+2Cl©Ғ
ЈЁ5Ј©Cl2+2NaOH=NaCl+NaClO+H2O
ЈЁ6Ј©68.5
ЎҫҪвОцЎҝҪвЈәXөДФӯЧУЧоНвІгөзЧУКэКЗҙОНвІгөДөзЧУКэөД2ұ¶Ј¬ЧоНвІгөзЧУКэІ»ДЬі¬№э8ёцЈ¬ФтЖдҙОНвІгКЗKІгЈ¬ЧоНвІгКЗLІгЈ¬LІгЙПөзЧУКэКЗ4Ј¬ФтRФӯЧУәЛНвөзЧУКэ=2+4=6Ј¬ЛщТФёГФӘЛШКЗCФӘЛШЈ»YөҘЦККЗЛ«ФӯЧУ·ЦЧУЈ¬ЗТЖдЗв»ҜОпЛ®ИЬТәПФјоРФЈ¬ҝЙЦӘYКЗNФӘЛШЈ»TФӘЛШФӯЧУөДЧоНвІгөзЧУКэКЗөзЧУІгКэ2ұ¶өДФӘЛШЈ¬УЙФӯЧУРтКэ№ШПөҝЙЦӘTОӘSФӘЛШЈ»ZөДЧоёЯХэјЫОӘ+7јЫЈ¬УҰОӘClФӘЛШ.
ЈЁ1.Ј©Н¬ЦЬЖЪЧФЧу¶шУТФӯЧУ°лҫ¶јхРЎЈ¬Н¬ЦчЧеЧФЙП¶шПВФӯЧУ°лҫ¶Фцҙ󣬹КФӯЧУ°лҫ¶SЈҫClЈҫCЈҫNЈ¬ЛщТФҙр°ёКЗЈәSЈҫClЈҫCЈҫNЈ»
ЈЁ2.Ј©YH4+ОӘп§ёщАлЧУЈ¬өзЧУКҪОӘ 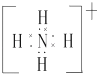 Ј¬ЛщТФҙр°ёКЗЈә
Ј¬ЛщТФҙр°ёКЗЈә  Ј»
Ј»
ЈЁ3.Ј©БтАлЧУәЛНвУР3ёцөзЧУІгЈ¬ЧоНвІгөзЧУКэОӘ8Ј¬Ҫб№№КҫТвНјОӘ 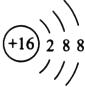 Ј¬
Ј¬
ЛщТФҙр°ёКЗЈә 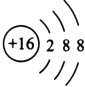 Ј»
Ј»
ЈЁ4.Ј©·ЗҪрКфөД·ЗҪрКфРФФҪЗҝЈ¬ЖдјтөҘТхАлЧУөД»№ФӯРФФҪИхЈ¬ЖдөҘЦКөДСх»ҜРФФҪЗҝЈ¬БтАлЧУДЬ»№ФӯВИЖшЙъіЙВИАлЧУЈ¬ЛщТФБтАлЧУ»№ФӯРФҙуУЪВИАлЧУЈ¬АлЧУ·ҪіМКҪОӘCl2+S2©Ғ=S+2Cl©ҒЛщТФҙр°ёКЗЈәCl2+S2©Ғ=S+2Cl©ҒЈ»
ЈЁ5.Ј©ВИЖшУлЗвСх»ҜДЖИЬТә·ҙУҰЙъіЙВИ»ҜДЖәНҙОВИЛбДЖЈ¬·ҪіМКҪОӘCl2+2NaOH=NaCl+NaClO+H2OЈ¬ЛщТФҙр°ёКЗЈәCl2+2NaOH=NaCl+NaClO+H2OЈ»
ЈЁ6.Ј©nЈЁCЈ©= ![]() =0.75molЈ¬nЈЁNaOHЈ©=1LЎБ1molL©Ғ1=1molЈ¬¶юХЯ·ўЙъ3CO2+4NaOH=Na2CO3+2NaHCO3+2H2OЈ¬УЙ·ҪіМКҪҝЙЦӘЙъіЙ0.25molNa2CO3Ўў0.5molNaHCO3 Ј¬ ЦКБҝОӘ0.25molЎБ106g/mol+0.5molЎБ84g/mol=68.5gЈ®ЛщТФҙр°ёКЗЈә68.5Ј®
=0.75molЈ¬nЈЁNaOHЈ©=1LЎБ1molL©Ғ1=1molЈ¬¶юХЯ·ўЙъ3CO2+4NaOH=Na2CO3+2NaHCO3+2H2OЈ¬УЙ·ҪіМКҪҝЙЦӘЙъіЙ0.25molNa2CO3Ўў0.5molNaHCO3 Ј¬ ЦКБҝОӘ0.25molЎБ106g/mol+0.5molЎБ84g/mol=68.5gЈ®ЛщТФҙр°ёКЗЈә68.5Ј®



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ»·ҫіОЫИҫТСіЙОӘИЛАаЙз»бГжБЩөДЦШҙуНюРІЈ¬ёчЦЦОЫИҫКэІ»КӨКэЈ¬ПВБРГыҙКУл»·ҫіОЫИҫОЮ№ШөДКЗ( )
ўЩОВКТР§УҰ ўЪіаіұ ўЫЛбУк ўЬ№в»ҜС§ОЫИҫ ўЭіфСхІгҝХ¶ҙ ўЮЛ®Щ¶ІЎ ўЯіұП« ўаҙуІұЧУІЎ
A.ўЩўЪ
B.ўЯўа
C.ўЮўЯўа
D.ўЪўЭўЯ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝјәЦӘЖПМСМЗөДҪб№№јтКҪОӘCH2OHЈЁCHOHЈ©4CHOЈ¬УЙҙЛЕР¶ППВБР№ШУЪЖПМСМЗРФЦКөДРрКцЦРІ»ХэИ·өДКЗЈЁ Ј©
A.ЖПМСМЗДЬ·ўЙъхҘ»Ҝ·ҙУҰ
B.ЖПМСМЗҫЯУР»№ФӯРФ
C.ЖПМСМЗід·ЦИјЙХөДІъОпОӘCO2УлH2O
D.НкИ«ИјЙХөИЦКБҝөДЖПМСМЗәНјЧИ©Ј¬ЛщРиСхЖшОпЦКөДБҝІ»ПаН¬
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЈЁ1Ј©РҙіцПВБРОпЦКФЪЛ®ЦРөДөзАл·ҪіМКҪ
МјЛбЗвДЖ______________________________________________________________ЎЈ
СЗБтЛб________________________________Ј¬______________________________ЎЈ
ЈЁ2Ј©ТСЦӘ25 ЎжКұУР№ШИхЛбөДөзАлЖҪәвіЈКэИзПВЈәHCN:4.9ЎБ10Јӯ10Ј¬H2CO3:K1ЈҪ4.4ЎБ10Јӯ7 K2ЈҪ4.7ЎБ10Јӯ11Ј¬ПтNaCNИЬТәЦРНЁИлЙЩБҝ¶юСх»ҜМјЖшМеЈ¬Рҙіц·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪ_____ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТ»¶ЁМхјюПВҪ«0.1 mol N2әН0.3 mol H2ЦГУЪГЬұХИЭЖчЦР·ўЙъ·ҙУҰN2+3H2![]() 2NH3ЎЈПВБР№ШУЪёГ·ҙУҰөДЛө·ЁХэИ·өДКЗ
2NH3ЎЈПВБР№ШУЪёГ·ҙУҰөДЛө·ЁХэИ·өДКЗ
A. ЧоЦХҝЙЙъіЙ0.2 mol NH3 B. өұn(N2):n(H2)=1:3КұЈ¬·ҙУҰТ»¶Ёҙп»ҜС§ЖҪәв
C. ЙэёЯОВ¶И·ҙУҰЛЩВКФцҙу D. ФцҙуС№Зҝ·ҙУҰЛЩВКјхРЎ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРУГЖ·өДЦчТӘіЙ·ЦІ»ХэИ·өДКЗ
A | B | C | D | |
УГЖ· | Л®ІЈБ§ | Ў°84ЎұПы¶ҫТә | РЎЛХҙт | №вөјПЛО¬ |
ЦчТӘіЙ·Ц | Na2SiO3 | NaClO | NaHCO3 | Si |
A. A B. B C. C D. D
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝИзНјAЎўBЎўCИэёцЙХұӯЦР·ЦұрКўУРПаН¬ОпЦКөДБҝЕЁ¶ИөДПЎБтЛбЈ® 
ЈЁ1Ј©BЦРSnј«ЙПіцПЦөДПЦПу
ЈЁ2Ј©CЦРZnЖ¬ЙПөДөзј«·ҙУҰКҪОӘЈ»
ЈЁ3Ј©AЎўBЎўCЦРМъИЬҪвөДЛЩВКУЙҝмөҪВэөДЛіРтКЗ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝјИДЬ·ўЙъјУіЙ·ҙУҰЈ¬УЦДЬ·ўЙъФн»Ҝ·ҙУҰөДКЗ( )
A.ЦІОпУН
B.ёКУН
C.УНЛб
D.ИнЦ¬Лб
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДі»ҜС§РЛИӨРЎЧйөДН¬С§НЁ№эІйФДЧКБПЈ¬»сөГБЛІЭЛбөДТ»Р©РЕПўЈ¬ХыАніцПВұнЎЈ
Ҫб№№јтКҪ | HOOC-OOH |
ИЬҪвРФ | ДЬИЬУЪЛ®Ј¬ТЧИЬУЪТТҙј |
МШРФ | ҙуФјФЪ157ЎжЙэ»Ә(175ЎжТФЙП·ўЙъ·ЦҪв) |
»ҜС§РФЦК | H2C2O4+Ca(OH)2=CaC2O4Ўэ+2H2O |
HOOC-COOH | |
2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4+10CO2Ўь+8H2O |
ЈЁ1Ј©ёГЧйН¬С§УыНЁ№эКөСйСйЦӨІЭЛбКЬИИ·ЦҪвІъОпЦРөДCO2әНCO(Ч°ЦГ·ыәПЖшГЬРФТӘЗуЈ¬ЖдЛыКФјБҝЙСЎ)ЎЈ

ўЩМоРҙұнЦРҝХДЪЎЈ
ТЗЖч | A | B | C |
јУИлКФјБ | ________ | ________ | NaOHИЬТә |
ўЪјтКцјмСйCOөДКөСй·Ҫ·ЁәНКөСйПЦПу__________________ЎЈ
ЈЁ2Ј©КөСйКТіЈУГІЭЛбДЖІв¶ЁKMnO4ИЬТәөДЕЁ¶ИЎЈ
ўЩЧјИ·іЖИЎ2.680gІЭЛбДЖЈ¬ИЬУЪПЎБтЛбәНЛ®ЦЖіЙ100.0 mLИЬТәЈ¬ГҝҙОИЎ20.00mLИЬТәУЪЧ¶РОЖҝЦРЈ»Ҫ«ҙэІвKMnO4ИЬТәЦГУЪ_______________(МоЎ°ЛбКҪЎұ»тЎ°јоКҪЎұ)өО¶Ё№ЬЦРҪшРРөО¶ЁЎЈЦШёҙЙПКцөО¶ЁІЩЧчИэҙОЈ¬КөСйКэй§ИзПВұнЛщКҫЎЈҙэІвKMnO4ИЬТәөДОпЦКөДБҝЕЁ¶ИОӘ____________ЎЈ
өО¶ЁЗ°ҫщОӘ | өЪТ»ҙОЦХөг | өЪ¶юҙОЦХөг | өЪИэҙОЦХөг | |
өО¶Ё№ЬТәГжҝМ¶И | 0.00 mL | 20.02mL | 21.00mL | 19.98mL |
ўЪҪ«ЛбРФKMnO4ИЬТәәНH2C2O4ИЬТә»мәПәуЈ¬·ўПЦҝӘКјКұИЬТәНКЙ«І»ГчПФЈ¬ө«І»ҫГәуСёЛЩНКЙ«Ј¬Хл¶ФёГКөСйПЦПуЈ¬ДіН¬С§ИПОӘKMnO4ИЬТәУлH2C2O4ИЬТәөД·ҙУҰКЗ·ЕИИ·ҙУҰЈ¬өјЦВИЬТәОВ¶ИЙэёЯЈ¬·ҙУҰЛЩВКјУҝмЎЈДгІВПл»№УРҝЙДЬКЗ_____________өДУ°ПмЎЈИфУГКөСйЦӨГчДгөДІВПлЈ¬іэKMnO4ИЬТәЎўH2C2O4ИЬТәЎўПЎБтЛбНвЈ¬»№РиТӘСЎФсөДәПАнКФјБКЗ__________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com