
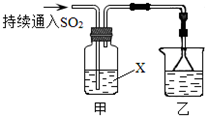
 某化学兴趣小组用以下装置探究SO2的某些化学性质.
某化学兴趣小组用以下装置探究SO2的某些化学性质. Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O=
 Cl-+
Cl-+ SO42-+
SO42-+


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| 浓硫酸 |
| 加热 |
| 浓硫酸 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江嵊泗中学高二下学期第二次月考化学卷(7、8班)(带解析) 题型:实验题
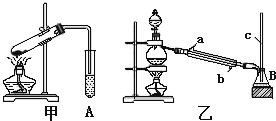
某化学兴趣小组用以下装置,以环己醇制备环己烯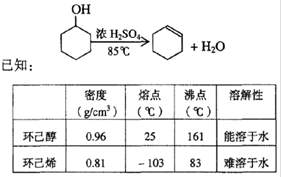
(1)制备粗品
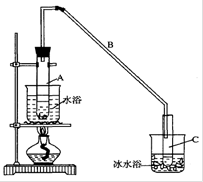
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热
至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图装置蒸馏,冷却水 从_________口进入。蒸馏时要加入生石灰,目的是__________________。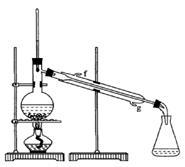
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 。
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省宁德市高三1月单科质量检查考试化学试卷(解析版) 题型:填空题
某化学兴趣小组用以下装置探究SO2的某些化学性质。
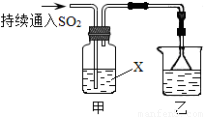
(1)装置乙的作用是????????????????????????? 。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有??????????????? (填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有????????????? 。
a.氧化性???????????? b.还原性???????????? c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式:
 Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O= ????? ↓+
????? ↓+ Cl-+
Cl-+ SO42-+
SO42-+ ???? 。
???? 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江嵊泗中学高二下学期第二次月考化学卷(7、8班)(解析版) 题型:实验题
某化学兴趣小组用以下装置,以环己醇制备环己烯

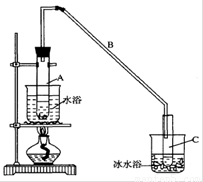
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热
至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图装置蒸馏,冷却水 从_________口进入。蒸馏时要加入生石灰,目的是__________________。
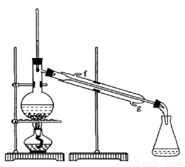
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 。
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com