
元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )
A.HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱
B.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
C.第ⅠA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈
D.门捷列夫在前人工作的基础上发现了元素周期律,表明科学研究既要继承又要创新
科目:高中化学 来源:2014高考化学名师综合题专练 化学实验练习卷(解析版) 题型:实验题
某研究性学习小组为合成1 丁醇,查阅资料得知一条合成路线:
丁醇,查阅资料得知一条合成路线:
CH3CH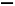 CH2+CO+H2
CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO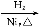 CH3CH2CH2CH2OH;
CH3CH2CH2CH2OH;
CO的制备原理:HCOOH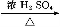 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
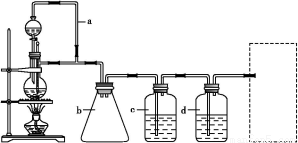
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2 丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式: , 。
丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式: , 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 , 。c和d中盛装的试剂分别是 , 。若用以上装置制备H2,气体发生装置中必需的玻璃仪器名称是 ;在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 (填序号)。
①饱和Na2SO3溶液;②酸性KMnO4溶液;③石灰水;④无水CuSO4;⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是 。
a.低温、高压、催化剂
b.适当的温度、高压、催化剂
c.常温、常压、催化剂
d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1 丁醇粗品。为纯化1
丁醇粗品。为纯化1 丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)
丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和) RCH(OH)SO3Na↓;②沸点:乙醚34℃,1
RCH(OH)SO3Na↓;②沸点:乙醚34℃,1 丁醇 118℃,并设计出如下提纯路线:
丁醇 118℃,并设计出如下提纯路线:
粗品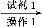 滤液
滤液
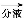 有机层
有机层 1
1 丁醇、乙醚
丁醇、乙醚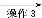 纯品
纯品
试剂1为 ,操作1为 ,操作2为 ,操作3为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题9溶液中的电离平衡练习卷(解析版) 题型:选择题
25 ℃时,水的电离达到平衡:H2O H++OH-
H++OH- 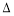 H>0,下列叙述正确的是( )
H>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题7元素周期表与元素周期律练习卷(解析版) 题型:填空题
短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置 ,
E的原子结构示意图是 。
下列可以验证C与D两元素原子得电子能力强弱的实验事实是 (填写编号)。
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式 。
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为 ,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 。
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式 。
②上述反应生成的两种碱继续作用,得到Fe3O4。
(5)已知下表数据:
物质 | Fe(OH)2 | Fe(OH)3 |
Ksp/25 ℃ | 2.0×10-16 | 4.0×10-36 |
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0 mol·L-1,则混合液中c(OH-)不得大于 mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题7元素周期表与元素周期律练习卷(解析版) 题型:填空题
短周期元素A、B、C、D在周期表中的位置如图,E2+与D的简单阴离子有相同的电子层结构,回答下列问题:

(1)设A、B、C、D四种元素的原子序数之和为m,则m 。
A.一定为奇数
B.一定为偶数
C.可能为奇数,也可能为偶数
(2)D元素原子的次外层电子数等于其他层电子数之和,则:
①写出A形成的简单离子的结构示意图 ,元素D位于元素周期表的第 族。
②A元素的一种氢化物分子中有6个原子,其结构简式为 。常压298 K时0.2 mol该气态氢化物在O2 中完全燃烧,生成气态A单质和水,放出热量106.8 kJ,该气态氢化物燃烧的热化学方程式为 。
③写出C单质与B的最简单氢化物反应的化学方程式:
④实验证实AC3与水会发生反应生成HNO2和HF,则AC3和NaOH溶液反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题6原子结构化学键练习卷(解析版) 题型:选择题
日本大地震引发的福岛第一核电站核泄漏事故,造成放射性物质碘和铯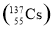 向外界泄漏。下列相关说法错误的是( )
向外界泄漏。下列相关说法错误的是( )
A.每个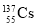 原子中有82个中子
原子中有82个中子
B.CsOH的碱性比KOH强
C.KIO3是碘的最高价氧化物的水化物的盐
D.I-比F-还原性强
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题5化学能与热能练习卷(解析版) 题型:填空题
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。
SiC Si;SiCl4 SiO2。
(2)如图立方体中心的“”表示硅晶体中的一个原子,请在立方体的顶点用“”表示出与之紧邻的硅原子。

(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)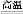 Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。
Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题4氧化还原反应练习卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.1 mol Cl2参加反应转移电子数一定为2NA
B.在反应KIO3+6HI KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
C.根据反应中HNO3(稀)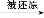 NO,而HNO3(浓)
NO,而HNO3(浓)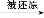 NO2可知,氧化性HNO3(稀)>HNO3(浓)
NO2可知,氧化性HNO3(稀)>HNO3(浓)
D.含有大量NO3—的溶液中,不能同时大量存在H+、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题22物质的检验、分离和提纯练习卷(解析版) 题型:选择题
某无色溶液中含有K+、Cl-、OH-、S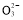 、S
、S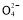 ,为了检验除OH-外的其他所有阴离子,拟用盐酸、硝酸、硝酸银溶液、氢氧化钡溶液、溴水和酚酞六种试剂,设计如下实验步骤,并记录相关现象:
,为了检验除OH-外的其他所有阴离子,拟用盐酸、硝酸、硝酸银溶液、氢氧化钡溶液、溴水和酚酞六种试剂,设计如下实验步骤,并记录相关现象:
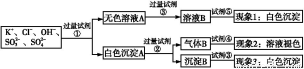
下列有关结论错误的是( )
A.试剂③是AgNO3溶液,试剂⑤是HNO3,现象1中白色沉淀是AgCl
B.现象3中白色沉淀是BaSO4
C.试剂②是盐酸,试剂③是硝酸
D.产生现象2的离子方程式是:Br2+2H2O+SO2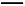 4H++2Br-+S
4H++2Br-+S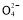
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com