
【题目】汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致:N2(g)+O2(g)![]() 2NO(g) △H>0。
2NO(g) △H>0。
己知该反应在2404℃时,平衡常数K = 6.4×10-3。请回答下列问题。
(1)该反应的平衡常数表达式为__________。
(2)该温度下,向2L密闭容器中充入N2和O2各lmol,平衡时,N2的转化率是_____%(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L、3.0×10-3mol/L,此时反应______(填“处于化学平衡状态”、“向正方向进行”或“向逆方向进行”),理由是__________。
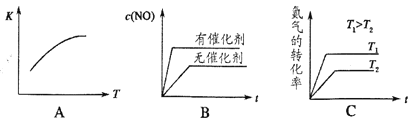
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是_____。
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2, 达到平衡状态后再向其中充入一定量NO, 重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数____(填“变大”、“变小”或“不变”)。
【答案】 K=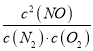 4 向正方向进行
4 向正方向进行 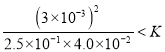 AC 不变
AC 不变
【解析】试题分析:汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致: N2(g)+O2(g)![]() 2NO(g)ΔH>0。已知该反应在2404℃时,平衡常数K=6.4×10-3。
2NO(g)ΔH>0。已知该反应在2404℃时,平衡常数K=6.4×10-3。
请回答下列问题。
(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据方程式可知该反应的平衡常数表达式为K=![]() 。
。
(2)该温度下,向2 L密闭容器中充入N2和O2各1mol,设平衡时消耗氮气和氧气均是xmol,则生成NO设2xmol,所以根据平衡常数可知![]() ,解得x=0.04,则N2的转化率是4%。
,解得x=0.04,则N2的转化率是4%。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,则此时浓度商=![]() <K,所以此时反应向正方向进行。
<K,所以此时反应向正方向进行。
(4)A、正反应吸热,则升高温度平衡向正反应方向进行,平衡常数增大,A正确;B、催化剂不能改变平衡状态,B错误;C、正反应吸热,则升高温度平衡向正反应方向进行,氮气额转化率增大,C正确,答案选AC。向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,由于反应前后体积不变,则相当于增大压强,平衡不移动,因此重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数不变。


科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。

下列说法正确的是
A. 卤素单质(X2)与水反应均可生成两种酸
B. 用电子式表示MgF2的形成过程为: ![]()
C. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
D. 由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为:MgI2(s)+Cl2(g)=MgCl2(s)+I2(g),ΔH=-277kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组各有两对物质,它们都能用分液漏斗分离的是
A. 四氯化碳和水,酒精和水 B. 汽油和水,苯和水
C. 甘油和水,乙醇和水 D. 醋酸和水,植物油和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4Al2(SO4)32Al2O36H2O,还含有杂质Fe2O3 . 利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示. 
请回答下列问题:
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4) ![]() 2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3 , 转移的电子数目为 .
2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3 , 转移的电子数目为 .
(2)生成沉淀I的离子方程式为 , 沉淀II的化学式为 .
(3)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀I,证明沉淀I已洗涤干净的实验操作和现象是 .
(4)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式: .
(5)从滤液中得到K2SO4晶体的方法是 .
(6)K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对甲烷、乙烯性质的描述中,不正确的是( )
A.乙烯能使溴水褪色
B.在一定条件下,乙烯自身加聚生成聚乙烯
C.甲烷能使酸性高锰酸钾溶液褪色
D.在光照条件下,甲烷与氯气发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:△G=△H-T△S,当△G<0,反应能自发进行,△G>0反应不能自发进行。生产合成气的反应:C(s) + H2O(g)=CO(g) + H2(g)在高温时才能自发进行。下列对该反应过程的ΔH、ΔS判断正确的是( )
A.ΔH>0,ΔS<0B.ΔH<0,ΔS<0C.ΔH>0,ΔS>0D.ΔH<0,ΔS>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
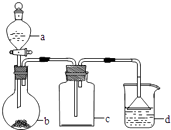
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量法是研究化学变化规律的重要思想方法。请仔细观察下表中50 mL稀盐酸和1 g碳酸钙反应的实验数据:
实验序号 | 碳酸钙状态 |
| 溶液温度/℃ | 碳酸钙消失所需时间/s | |
反应前 | 反应后 | ||||
1 | 粒状 | 0.5 | 20 | 39 | 400 |
2 | 粉末 | 0.5 | 20 | 40 | 60 |
3 | 粒状 | 0.6 | 20 | 41 | 280 |
4 | 粒状 | 0.8 | 20 | 40 | 200 |
5 | 粉末 | 0.8 | 20 | 40 | 30 |
6 | 粒状 | 1.0 | 20 | 40 | 120 |
7 | 粒状 | 1.0 | 30 | 50 | 40 |
8 | 粒状 | 1.2 | 20 | 40 | 90 |
9 | 粒状 | 1.2 | 25 | 45 | 40 |
分析并回答下列问题:
(1)本反应属于 (填“吸热”或“放热”)反应,反应的离子方程式为 。
(2)实验6和7表明, 对反应速率有影响, 反应速率越大,能表明同一规律的实验还有
(填实验序号)。
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是 。
(4)本实验中影响反应速率的其他因素还有 ,能表明这一规律的实验序号是1、2与 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L1 K2CO3溶液:Na+、Ba2+、ClO 、OH
B.0.1 mol·L1 Al2(SO4)3溶液:Na+、NH4+ 、OH、Cl
C.0.1 mol·L1 HCl 溶液:Ba2+、K+、CH3COO、NO3
D.0.1 mol·L1 NaOH溶液:K+、Na+、SO42、CO32
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com