
【题目】碳、硅元素的单质及其化合物是构成自然界的重要物质.
(1)甲烷是最简单的有机物,实验室可通过下列反应制取:
CH3COONa+NaOH ![]() CH4↑+X(已配平)
CH4↑+X(已配平)
①X属于晶体(填晶体类型);
②MgO晶体的熔点比CaO高,主要原因是 .
(2)C60、金刚石和石墨是三种重要的碳单质,结构模型分别如图所示(其中石墨仅表示出其中的一层结构). 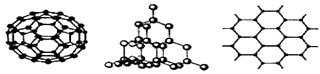
①金刚石中碳原子的杂化方式为;
②石墨层状结构中,平均每个正六边形占有的C﹣C键数是个.
【答案】
(1)离子;Mg2+半径比Ca2+小,因此MgO晶体的晶格能较大,熔点较高
(2)sp3;3
【解析】解:(1.)①根据元素守恒及原子守恒知,X是碳酸钠,碳酸钠是由阴阳离子构成的离子晶体;所以答案是:离子;②MgO晶体的熔点比CaO高都属于离子晶体,Mg2+半径比Ca2+小,键能较大,所以氧化镁晶体的晶格能大于氧化钙,导致氧化镁晶体的熔点大于氧化钙,所以答案是:Mg2+半径比Ca2+小,因此MgO晶体的晶格能较大,熔点较高;
(2.)①金刚石中每个碳原子和4个碳原子以σ键相结合,且没有孤对电子,所以每个碳原子的价层电子对是4,则碳原子采取sp3杂化,所以答案是:sp3;②石墨层状结构中,每个碳原子被三个正六边形共用,所以平均每个正六边形占有的碳原子数=6× ![]() 3;所以答案是:3.
3;所以答案是:3.


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度a(吸附O2的Hb或Mb占总Hb或Mb的比例)和氧分压p(O2)密切相关。
I .Hb与氧气的结合能力还受到c(H+)的影响,平衡如下:
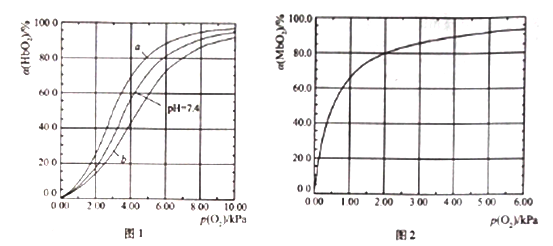
HbO2(aq)+H+(aq) ![]() HbH+(aq)+O2(g) (反应①)。37℃,PH分别为7.2、7.4、7.6 时氧分压p(O2)和达平衡时的结合度的关系如图1
HbH+(aq)+O2(g) (反应①)。37℃,PH分别为7.2、7.4、7.6 时氧分压p(O2)和达平衡时的结合度的关系如图1
(1)图1中pH=7.6时的曲线为______ (填“a”或“b”)。
(2)血液中还存在平衡:CO2+H2O![]() H2CO3
H2CO3![]() H++HCO3-(反应②),用平衡理论解释肺部高氧分压有利于CO2排出体外的原因___________。
H++HCO3-(反应②),用平衡理论解释肺部高氧分压有利于CO2排出体外的原因___________。
II.Mb与氧气结合的平衡如下:Mb(aq)+O2(g) ![]() MbO2(aq)(反应③),37℃时,氧分压p(O2)和达平衡时的结合度的关系如图2。
MbO2(aq)(反应③),37℃时,氧分压p(O2)和达平衡时的结合度的关系如图2。
(3)若肌肉中Mb的初始浓度为c0 mol/L,结合度达到50%所需的时间为t min,此段时间内用MbO2表示的平均反应速率为____________。
(4)图2中a随p(O2)增大而增大的原因是______________。
(5) Mb与氧气结合的平衡常数的表达式K=![]() ,计算37℃时K=____________。
,计算37℃时K=____________。
(6) Mb与氧气结合达平衡时结合度a=____________ [用含p(O2)和K的代数式表示]。
人正常呼吸时,温度约为37℃,空气中氧分压约为20.0kPa,计算此时Mb与氧气的最大结合度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
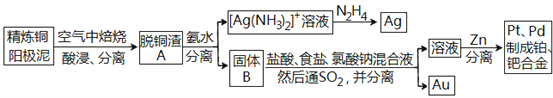
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用,如回收利用电解精炼铜的阳极泥中含有的银、铂、金等贵重金属。提炼阳极泥的方法有多种,湿法提炼是其中重要的一种,其主要生产流程如下:
请回答下列问题:
(1)各步生产流程中都涉及了同一种分离方法,该方法需要的玻璃仪器有玻璃棒和_______。
(2)脱铜渣A中含有AgCl,它溶于浓氨水的离子方程式为________________。
(3)已知N2H4被银氨溶液氧化的产物是氮气,则每生成1molAg,需要消耗_______g N2H4。
(4)固体B中单质Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4;在NaAuCl4中Au元素的化合价为______,该反应的离子方程式为____________________。
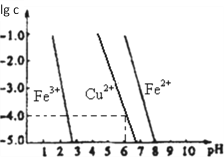
(5)阳极泥中的铜可以用FeC13溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合如图分析:(其中的纵坐标代表金属阳离子浓度的对数)
①要从浸出液中提纯铜,最好先加入酸化的双氧水,目的是_______________,然后加入适量的CuO调节pH=3.7,除去______离子;
②从图中数据计算可得Cu(OH)2的Ksp约为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶14%的KOH溶液,加热蒸发掉100g水后,变为28%的KOH溶液80mL,这80mL溶液的物质的量浓度为( )
A. 5mol/L B. 6mol/L C. 6.25mol/L D. 6.75mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是( )
A.二氧化碳和干冰互为同素异形体
B.金刚石是碳的一种同位素
C.C60与金刚石一样属于原子晶体
D.水结冰体积膨胀、密度变小,这一事实与水中存在氢键有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一氧化碳与水蒸气的反应为:CO(g)+H2O (g)![]() CO2 (g)+H2 (g),在427℃时的平衡常数是9.4。回答下列问题:
CO2 (g)+H2 (g),在427℃时的平衡常数是9.4。回答下列问题:
(1)氢气作为燃料与汽油相比,其优点是____________________________________________(答一条即可)。
(2)800℃时,在容积为2.0L的密闭容器中充入2.0mlCO(g)和3.0molH2O(g),保持温度不变,4min后
反应达到平衡,测得CO的转化率为60%。
①4min内H2的平均化学反应速率为__________mol/(L·min)。
②800℃时该反应的平衡常数值为__________。请结合题中的信息判断该反应的△H__________0。
(3)一定条件下,设起始加入二氧化碳和氢气且![]() = Z,在恒压下.平衡时CO2的体积分数φ(CO2) 与Z和T(温度)的关系如图所示,下列说法正确的是(_____)
= Z,在恒压下.平衡时CO2的体积分数φ(CO2) 与Z和T(温度)的关系如图所示,下列说法正确的是(_____)

A.该反应的焓变△H>0
B.图中Z的大小为b>3>a
C.图中x 点对应的平衡混合物中![]() = 3
= 3
D.温度不变时,图中x点对应的平衡在加压后φ(CO2)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作不能用于检验NH3的是( )
A. 气体使湿润的酚酞试纸变红 B. 气体使湿润的红色石蕊试纸变蓝
C. 气体与浓硫酸靠近 D. 气体与浓盐酸靠近
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,下列说法中,正确的是( )
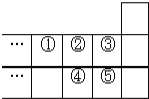
A. 元素的最高正化合价:![]()
B. 一定条件下,①和②的单质都只能形成一种氢化物
C. 38 g ③的单质跟足量水反应时,发生转移的电子为1mol
D. 元素④在自然界中存在游离态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com