
| A、1mo1的Fe在1mo1Cl2中充分燃烧,转移电子数为3NA |
| B、7.2g CaO2中的阴离子含有的电子数为1.0NA |
| C、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA |
| D、标准状况下,22.4L盐酸含有2NA个离子 |


科目:高中化学 来源: 题型:
A、按照系统命名法, 的名称为3,3-二甲基-2-乙基戊烷 的名称为3,3-二甲基-2-乙基戊烷 |
B、 能使KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变得活泼,被KMnO4氧化而断裂 能使KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变得活泼,被KMnO4氧化而断裂 |
C、1mol 可以与2mol NaOH反应 可以与2mol NaOH反应 |
D、1mol绿原酸 通过消去反应脱去1mol H2O时,能得到6 种不同产物(不考虑立体异构) 通过消去反应脱去1mol H2O时,能得到6 种不同产物(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、31P和32P具有相同的中子数 |
| B、31P和32P互为同位素 |
| C、31P和32P的核外电子数不同 |
| D、31P和32P的中子数分别为31和32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子晶体中一定存在共价键 |
| B、原子晶体中可能存在离子键 |
| C、金属晶体中存在离子,但却不存在离子键 |
| D、分子晶体中一定存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
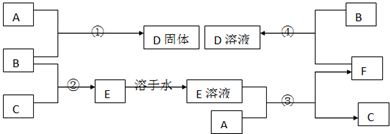
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com