
【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________,该反应为______反应(填吸热或放热)。[
若改变条件使平衡向正反应方向移动,则平衡常数_________(填序号)
①一定不变②一定减小③可能增大④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是___________。
(a)容器中压强不变(b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O)(d)c(CO)=c(CO2)
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃[ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 1000 | 1 | 2 | c | d | t |
①实验B中平衡时H2O(g)的物质的量是。
②通过计算可知,CO的转化率实验A实验B(填“大于”、“等于”或“小于”)。
③若实验C中达到平衡所需时间t3(填“大于”、“等于”或“小于”)
【答案】
(1)K=![]() ;放热;
;放热;
(2)bc;
(3)①0.6mol;②大于;③小于
【解析】
试题分析:(1)平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,则K=![]() ,温度升高平衡常数减小,说明平衡向逆反应方向移动,则正反应为放热反应,若改变条件使平衡向正反应方向移动,由于平衡常数只与温度有关,如果改变温度,平衡常数一定增大,如果温度不变,平衡常数不变,故选③,故答案为:K=
,温度升高平衡常数减小,说明平衡向逆反应方向移动,则正反应为放热反应,若改变条件使平衡向正反应方向移动,由于平衡常数只与温度有关,如果改变温度,平衡常数一定增大,如果温度不变,平衡常数不变,故选③,故答案为:K=![]() ;放热;③;
;放热;③;
(2)(a)该反应属于气体体积不变的反应,容器中气体的压强始终不变,容器中压强不变,不能判断是否达到化学平衡状态,错误;(b)混合气体中c(CO)不变,则其它物质的浓度也不变,能够说明到化学平衡状态,正确;(c)v逆(H2)=v正(H2O)表示正逆反应速率相等,能够说明到化学平衡状态,正确;(d)c(CO)=c(CO2),不能判断是否达到化学平衡状态,错误;故选bc;
(3)①实验B中反应的CO为0.4mol,根据方程式,反应的水也是0.4mol,平衡时H2O(g)的物质的量为1mol-0.4mol=0.6mol,故答案为:0.6mol;
②实验A中CO的转化率=![]() =0.4,实验B中CO的转化率=
=0.4,实验B中CO的转化率=![]() =0.2,因此CO的转化率实验A大于实验B,故答案为:大于;
=0.2,因此CO的转化率实验A大于实验B,故答案为:大于;
③温度越高反应速率越快,达到平衡需要的时间越短,实验C中达到平衡所需时间t小于3,故答案为:小于。


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学
技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
电子表和电子计算器中所用的是纽扣式微型银锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,工作时电池总反应为Ag2O+Zn+H2O===2Ag+Zn(OH)2。
①工作时电流从________极流向________极(填“Ag2O”或“Zn”)。
②电极反应式:正极:_____________________,负极:_____________________。
③工作时电池正极区的pH________(填“增大”、“减小”或“不变”)。氢镍电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是![]() H2+NiO(OH)
H2+NiO(OH) ![]() Ni(OH)2。
Ni(OH)2。
电池放电时, 负极的电极反应式为_________,正极的电极反应式为________________,正极附近溶液的pH__________(填“增大”,“减小”或者“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:
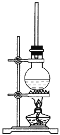
(1)在圆底烧瓶中加入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水和10 mL酒精,加入酒精的作用是 。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得的混合物为________(填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入___________,静置一段时间后,溶液分为上下两层,肥皂在上层,这个操作称为______________。
(4)图中长玻璃导管的作用为_________________________。
(5)写出该反应的化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全气囊是行车安全的重要设施。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客。为研究安全气囊工作的化学原理,取安全装置中的粉末进行研究。经实验分析,确定该粉末是一种混合物且只含Na、Fe、N、O四种元素。
(1)氧元素在元素周期表中的位置是__________________,Na原子结构示意图为_____________,其中三种主族元素的离子半径从大到小的顺序是___________________(用离子符号表示)。
(2)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐晶体中含有的化学键类型是____________________。
(3)水溶性实验表明,安全气囊中固体粉末部分溶解,不溶物为一种红棕色固体,可溶于盐酸,写出反应的化学方程式_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为KNO3和NaCl的溶解度曲线,请回答下列问题:
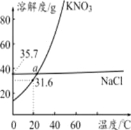
(1)20℃时, KNO3的溶解度为 。
(2)a点处KNO3和NaCl两种溶液中溶质的质量分数 (填“相等”或“不相等”)
(3)若固体KNO3中混有的少量NaCl,可采用 (填“蒸发结晶”或“降温结晶“)的方法提纯。
(4)40℃时,将35.0gNaCl溶于100g水中,降温至0℃时,可析出晶体 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列几种粒子的结构示意图,回答问题:
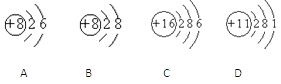
(1)属于阴离子的是______(填粒子代号,下同)
(2)属于金属元素的是_______________________
(3)具有相似化学性质的是____________________
(4)D2C2含有的化学键类型有___________________(选填“离子键”“极性键”“非极性键”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯仿(CHCl3,非电解质)在空气中能发生缓慢氧化,生成剧毒物质光气(COCl2,非电解质),化学方程式为2CHCl3+ O2="=" 2COCl2+ 2HCl。检验氯仿是否被氧化应选用的试剂是
A. 水 B. 硝酸酸化的硝酸银溶液
C. 酚酞溶液 D. 氢氧化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com