
X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于:
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于:
A、33% B、40% C、50% D、65%
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如图所示:
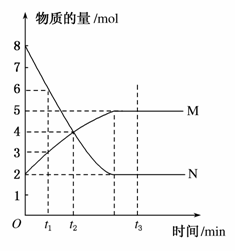
(1)此反应的化学方程式中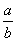 =________。
=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为______________________________________________________。
(3)下列叙述中能说明上述反应达到平衡状态的是________。
A.反应中M与N的物质的量之比为11
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.活化分子间所发生的碰撞为有效碰撞
B.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因之一是增加了单位体积内活化分子的百分数
D.有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
|

常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两个实验:
(N2O4 2NO2 △H > 0)
2NO2 △H > 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
已知,N2 (g) + 3H2(g)  2NH3(g) △H=-92.4 kJ·mol-1 。在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) △H=-92.4 kJ·mol-1 。在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol·L | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 |
|
|
|
下列说法正确的是
A.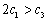 B.
B.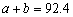 C.
C.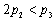 D.α1 +α2 > 1
D.α1 +α2 > 1
查看答案和解析>>
科目:高中化学 来源: 题型:
铜和稀硝酸在常温常压下反应,开始时反应非常慢,但是随着反应的进行,反应速率不断地加大。某校合作学习小组的同学拟探究影响其速率的主要因素。
(1) Cu与稀硝酸反应的离子方程式_ 。
(2)甲同学认为是生成的Cu2+对该反应起催化作用,欲验证其假设是否正确,其实验方法是:_ _ 。
(3)乙同学依据铜和硝酸是放热反应,拟研究温度升高是否为该反应速度率不断加大的主要原因,实验结果如下:
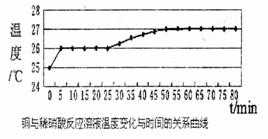
由此可得到的结论是_ _ 。
(4)丙同学查阅文献,得知稀硝酸与铜反应,还原产物起始也是NO2,NO2对该反应起催化作用。通过下列装置验证:
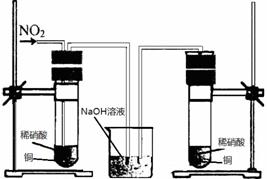
实验发现左侧3min后开始大量产生气泡,右侧40min内无明显变化。
①氢氧化钠溶液的作用是_ _ 。
②该学生设计在左侧加的是2mol·L-1 HNO3溶液,右侧加的是2.2 mol·L-1 硝酸。左侧浓度稍偏小,这样设计主要是考虑到_ 。
(5)丁同学与丙同学交流后,他将实验改进为:在试管中加入3mL2mol·L-1 HNO3并放入铜片,然后加入几粒NaNO2晶体,发现只需1秒钟,铜片表面就开始产生气泡。由丁的实验推断出的可能结论是:_ _ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在Al2(SO4)3和(NH4)2SO4的混合溶液中,逐滴加入NaOH溶液至过量。下列图示能正确表示生成沉淀的质量与滴入NaOH溶液体积关系的是( )
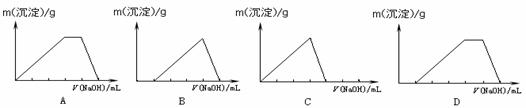
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
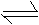 2N2O5(g) 4NO2(g)+O2(g) ΔH>0 ;T1温度下的部分实验数据为:
2N2O5(g) 4NO2(g)+O2(g) ΔH>0 ;T1温度下的部分实验数据为:
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A.500 s内N2O5分解速率为2.96×10-3 mol·(L·s)-1
B.T1温度下的平衡常数为K1=125, 1000 s时转化率为50%
C.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
D.其他条件不变时,T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com