
���� ��1��ˮ���������H+��OH-��Ũ�ȳ˻�����c��H+��ˮ•c��OH-��ˮ=10-26����c��H+��=10-13mol/L������Kw=10-12����c��OH����Ȼ������������Ƶ�������
�������¶Ȳ��䣬��ˮ��ͨ���HCl����ǡ��ʹ��Һ��$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=1010����֪Kw=10-12����c��H+��=0.1mol/L��Ȼ�����ˮ�����c��OH-����
��2��HClΪһԪǿ�ᣬH2SO4Ϊ��Ԫǿ�ᣬ�����pH��ͬʱ��c��H+����ͬ����CH3COOHΪ���ᣬ��c��CH3COOH����c��H+�������ʵ���Ũ����ͬʱ��c��H+����ϵ������������ݴ˷�����
��3���ɸ���ǿ����ϡ��ʱ��ҺPH�ı仯��ͬ��������
��4���ٵζ��������۾���Ҫ�۲���ƿ����Һ��ɫ�仯�����ж��ζ��յ㣻����ʱ����Ϊ��ɫ���ζ��յ�ʱ���ȱ�Ϊ��ɫ��
�ڸ���c�����⣩=$\frac{c��������V������}{V�����⣩}$��������������V��������Ӱ�죬�Դ��ж���
��� �⣺��1��ˮ���������H+��OH-��Ũ�ȳ˻�����c��H+��ˮ•c��OH-��ˮ=10-26����c��H+��=10-13mol/L����֪Kw=10-12��c��OH��=$\frac{1{0}^{-12}}{1{0}^{-13}}$=10mol/L�����������Ƶ����ʵ���Ϊ10mol/L��1L=10mol��������Ϊ10mol��40g/mol=400g��
�������¶Ȳ��䣬��ˮ��ͨ���HCl����ǡ��ʹ��Һ��$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=1010����֪Kw=10-12����c��H+��=0.1mol/L����ˮ�����c��OH-��=$\frac{1{0}^{-12}}{0.1}$=10-11mol/L��
�ʴ�Ϊ��400��10-11��
��2�������ʵ���Ũ����ͬ�������ͬʱ����������ʵ�����ͬ��1mol��������2molNaOH�����Դ����HCl��������1molNaOH������ʹ��ǡ����ȫ�к�����NaOH�����ʵ����ɴ�С��˳���ǣ�b��a=c��
�ʴ�Ϊ��b��a=c��
�ڵ���������Һ������Ũ����ͬ�����Ҳ��ͬʱ���ֱ��������п�����ڴ���Ϊ������ʣ���������ʵ���Ũ���������������Ϊǿ�ᣬ���е�������Ũ����ȣ�������ͬ״���²�������������ϵΪ��c��a=b��
�ʴ�Ϊ��c��a=b��
�۵���c��H+����ͬ�������ͬʱ����п��Ӧ���ɵ���������ʼʱ��������ͬ������a=b=c��
�ʴ�Ϊ��a=b=c��
��3������ϡ��ʱ�ٽ����룬������ϡ����ͬ�ı�������Һ�е�������Ũ�Ȳ������Ƚϣ����ȡ��������������������ˮϡ����ͬ��������100������Ȼ����pH��ֽ�ֱ����pHֵ��pHֵ�仯��������
�ʴ�Ϊ����ȡ��������������������ˮϡ����ͬ��������100������Ȼ����pH��ֽ�ֱ����pHֵ��pHֵ�仯��������
��4���ٵζ��������۾���Ҫ�۲���ƿ����Һ��ɫ�仯�����ж��ζ��յ㣻��0.2000mol•L-1�ı�������еζ�NaOH��Һ����ƿ��ΪNaOH��Һ�ͼ��ȣ�����ʱ����Ϊ��ɫ���ζ��յ�ʱ���ȱ�Ϊ��ɫ������ζ��յ�ʱ����Һ�ӻ�ɫ��Ϊ��ɫ�����Ұ�����ڲ��ָ�ԭ������ɫ��
�ʴ�Ϊ����ƿ����Һ��ɫ�仯���ƣ��ȣ����Ұ�����ڲ��ָ�ԭ������ɫ��
�ڹ۲���ʽ�ζ���Һ��ʱ����ʼ���ӣ��ζ��յ�ƽ�ӣ���ζ����������ƫ��V������ƫ����c�����⣩=$\frac{c��������V������}{V�����⣩}$��֪���ⶨ���ƫ�ߣ�
������ƿ�ô���Һ��ϴ���������Һ�����ʵ����ʵ���ƫ�����ĵı���Һ�����ƫ����c�����⣩=$\frac{c��������V������}{V�����⣩}$��֪���ⶨ���ƫ�ߣ�
�ʴ�Ϊ��ƫ�ߣ�ƫ�ߣ�
���� ���⿼���˻����Һ����Զ����жϡ�pH�ļ��㡢�к͵ζ���������������������Ŀ�Ѷ��еȣ�ע�����pH���йؼ��㡢�к͵ζ��IJ���������������������������ѧ���ķ�����������ѧʵ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
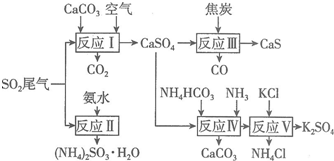
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����20 g ����NaOH�����衢�ܽ� | |
| B�� | ����Һ����Ũ����0.2 L | |
| C�� | ����10 mol/L��NaOH��Һ0.1 L����ϡ����1.5 L | |
| D�� | ����1 L 1.5 mol/L��NaOH��Һ��Ͼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 A��B��C�����ɶ�����Ԫ����ɵĵ��ʣ�D��E��F��G��H��I��Ϊ�����F�ڳ��³�ѹ��ΪҺ̬��IΪ���д��Եĺ�ɫ���壬��������ͼ��ʾ��ת����ϵ��
A��B��C�����ɶ�����Ԫ����ɵĵ��ʣ�D��E��F��G��H��I��Ϊ�����F�ڳ��³�ѹ��ΪҺ̬��IΪ���д��Եĺ�ɫ���壬��������ͼ��ʾ��ת����ϵ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����л����ת����ϵ��ͼ��ʾ����֪������W��X��Z������������������ͭ����Һ��Ӧ���ɺ�ɫ���壮X��Y����������ɵ����У�������
�����л����ת����ϵ��ͼ��ʾ����֪������W��X��Z������������������ͭ����Һ��Ӧ���ɺ�ɫ���壮X��Y����������ɵ����У�������| A�� | 2�� | B�� | 4�� | C�� | 6�� | D�� | 12�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ɷ�Ӧ�١��ڿ���֪��CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��g����H=-867 kJ•mol-1 | |
| B�� | �����ʵ����ļ���ֱ���뷴Ӧ�١��ڣ���Ӧת�Ƶĵ�������� | |
| C�� | ���ñ�״����4.48 L CH4��ԭNO2��N2���ų�������Ϊ173.4 kJ | |
| D�� | ���ñ�״����4.48 L CH4��ԭNO2��N2������������ת�Ƶĵ�������Ϊ3.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
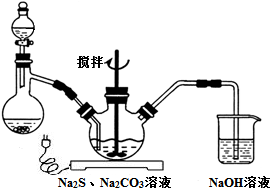
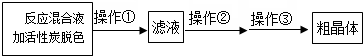
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | H2O������H-O�ļ���Ϊ462kJ?mol-1 | |
| B�� | H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H=-480 kJ?mol-1 | |
| C�� | H2��ȼ����Ϊ240 kJ?mol-1 | |
| D�� | ���ֽ�2molH2O��l����������Ҫ�ṩ4��462kJ������ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com