
ФГЪЕбщаЁзщгћЬНОПNa2CO3КЭNaHCO3ЕФаджЪЃЌЗЂЯжЪЕбщЪвРяЪЂЗХСНжжЙЬЬхЕФЪдМСЦПЖЊЪЇСЫБъЧЉЁЃгкЪЧЃЌЫћУЧЯШЖдЙЬЬхAЁЂBНјааМјБ№ЃЌдйЭЈЙ§ЪЕбщНјаааджЪЬНОПЁЃ
ЃЈ1ЃЉЗжБ№МгШШЙЬЬхAЁЂBЃЌЗЂЯжЙЬЬхAЪмШШВњЩњЕФЦјЬхФмЪЙГЮЧхЪЏЛвЫЎБфЛызЧЁЃAЪмШШЗжНтЕФЛЏбЇЗНГЬЪНЮЊ_________________________________ЁЃ
ЃЈ2ЃЉГЦШЁСНжжЙЬЬхИї2 gЃЌЗжБ№МгШыСНИіаЁЩеБжаЃЌдйИїМг10 mL еєСѓЫЎЃЌеёЕДЃЌВтСПЮТЖШБфЛЏЃЛД§ЙЬЬхГфЗжШмНтЃЌЛжИДжСЪвЮТЃЌЯђЫљЕУШмвКжаИїЕЮШы2ЕЮЗгЬЊШмвКЁЃ
ЂйЗЂЯжNa2CO3ЙЬЬхЭъШЋШмНтЃЌЖјNaHCO3ЙЬЬхгаЪЃгрЃЌгЩДЫЕУГіНсТл___________________ЁЃ
ЂкЭЌбЇУЧдкСНЩеБжаЛЙЙлВьЕНвдЯТЯжЯѓЁЃЦфжаЃЌЪЂЗХNa2CO3ЕФЩеБжаГіЯжЕФЯжЯѓЪЧ________________ЃЈЬюзжФИађКХЃЉЁЃ
AЃЎШмвКЮТЖШЯТНЕ BЃЎШмвКЮТЖШЩ§Ип CЃЎЕЮШыЗгЬЊКѓГЪЧГКьЩЋ DЃЎЕЮШыЗгЬЊКѓГЪКьЩЋ
ЃЈ3ЃЉШчЭМЫљЪОЃЌдкЦјУмадСМКУЕФзАжУЂёКЭЂђжаЗжБ№ЗХШывЉЦЗЃЌНЋЦјЧђФкЕФЙЬЬхЭЌЪБЕЙШыЪдЙмжаЁЃ

ЂйСНЪдЙмжаОљВњЩњЦјЬхЃЌ________ЃЈЬюЁАЂёЁБЛђЁАЂђЁБЃЉЕФЗДгІГЬЖШИќЮЊОчСвЁЃ
ЂкЗДгІНсЪјКѓЃЌЦјЧђОљгаХђеЭЃЌЛжИДжСЪвЮТЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ__________ЁЃ
AЃЎзАжУЂёЕФЦјЧђЬхЛ§НЯДѓ BЃЎзАжУЂђЕФЦјЧђЬхЛ§НЯДѓ
CЃЎЩњГЩЦјЬхЕФЬхЛ§ИљОнбЮЫсМЦЫу DЃЎЩњГЩЦјЬхЕФЬхЛ§ИљОнЙЬЬхМЦЫу
ЃЈ4ЃЉЭЌбЇУЧНЋСНжжЙЬЬхЗжБ№ХфжЦГЩ0.5 molЁЄL-1ЕФШмвКЃЌЩшМЦШчЯТЗНАИВЂЖдЗДгІЯжЯѓзіГідЄВтЃК
ЪЕбщЗНАИ | дЄВтЯжЯѓ | дЄВтвРОн |
Вйзї1ЃКЯђ2 mL Na2CO3ШмвКжаЕЮМг1 mL 0.5 molЁЄL-1CaCl2ШмвК | гаАзЩЋГСЕэ | Na2CO3ШмвКжаЕФCO32-ХЈЖШНЯДѓЃЌФмгыCaCl2ЗЂЩњЗДгІ_________ЃЈаДРызгЗНГЬЪНЃЉЁЃ |
Вйзї2ЃКЯђ2 mL NaHCO3ШмвКжаЕЮМг1 mL 0.5 molЁЄL-1CaCl2ШмвК | ЮоАзЩЋГСЕэ | NaHCO3ШмвКжаЕФCO32-ХЈЖШКмаЁЃЌВЛФмгыCaCl2ЗДгІЁЃ |
ЪЕЪЉЪЕбщКѓЃЌЗЂЯжВйзї2ЕФЯжЯѓгыдЄВтгаВювьЃКВњЩњАзЩЋГСЕэКЭЦјЬхЁЃдђИУЬѕМўЯТЃЌNaHCO3ШмвКгыCaCl2ШмвКЗДгІЕФРызгЗНГЬЪНЮЊ_______________ЁЃ
ЃЈ1ЃЉ2NaHCO3  Na2CO3 + CO2Ёќ+ H2O
Na2CO3 + CO2Ёќ+ H2O
ЃЈ2ЃЉЂй ЭЌЮТЖШЯТЃЌNa2CO3 БШNaHCO3взШмгкЫЎ Ђк BЁЂD
ЃЈ3ЃЉЂйЂё Ђк AЁЂC
ЃЈ4ЃЉCa2+ + CO32- = CaCO3Ё§ Ca2+ + 2HCO3- === CaCO3Ё§+ CO2Ёќ+ H2O
ЁОНтЮіЁП
ЪдЬтЗжЮіЃКЃЈ1ЃЉ Na2CO3ЮШЖЈЃЌЪмШШВЛЗжНтЃЌЖјNaHCO3ВЛЮШЖЈЃЌЪмШШЗжНтЁЃЗДгІЕФЗНГЬЪНЮЊ2NaHCO3  Na2CO3 + CO2Ёќ+ H2OЁЃЃЈ2ЃЉдкЯрЭЌЕФЮТЖШЯТЃЌдкЯрЭЌжЪСПЕФЫЎдкМгШыЯрЕШжЪСПЕФNa2CO3гыNaHCO3ЁЃНсЙћЗЂЯжNa2CO3ЙЬЬхЭъШЋШмНтЃЌЖјNaHCO3ЙЬЬхгаЪЃгрЫЕУїдкЯрЭЌЕФЮТЖШЯТNa2CO3БШNaHCO3ИќШнвзШмНтгкЫЎжаЁЃЂкЪЂЗХNa2CO3ЕФЩеБжаГіЯжЕФЯжЯѓЪЧМгЫЎШмНтЗХГіШШСПЪЙШмвКЕФЮТЖШЩ§ИпЃЌЕЮМгЗгЬЊЪдвККѓШмвКБфЮЊКьЩЋЃЌЫЕУїШмвКЯдМюадЁЃЫљвде§ШЗбЁЯюЮЊB DЁЃЃЈ3ЃЉЂйСНЪдЙмжаОљВњЩњЦјЬхЂёжаВњЩњЦјЬхИќПьЃЌЫљвдЂёЕФЗДгІГЬЖШИќЮЊОчСвЁЃЗЂЩњЕФЗДгІЮЊЃКNaHCO3+HCl=NaCl+H2O+ CO2Ёќn(NaHCO3) ЃКn(HCl)=1:1ЃЌ n(NaHCO3)=1/84mol=0.012mol<n(HCl)=0.003mol,ЫљвдЗХГіЕФЦјЬхЬхЛ§АДеебЮЫсРДМЦЫуЁЃNa2CO3+ 2HCl=2NaCl+H2O+ CO2Ёќn(Na2CO3) ЃКn(HCl)=1:2ЃЛn(Na2CO3)= 1/106mol= 0.009mol>2n(HCl)ЁЃЫљвдЗХГіЕФЦјЬхЕФЬхЛ§АДеебЮЫсРДМЦЫуЁЃвђЮЊЬМЫсФЦгыбЮЫсЗДгІЗжВННјааЃЌЕквЛВНВњЩњЬМЫсЧтФЦКЭТШЛЏФЦЃЌУЛгаЦјЬхЃЌЕкЖўВНВХЗХГіЦјЬхЃЌВЂЧвгыNa2CO3КЭNaHCO3ЗжБ№МгШыЕФбЮЫсЕФЬхЛ§ЯрЕШЃЌЫљвдЗХГіЦјЬхЕФЬхЛ§NaHCO3ЖрЁЃвђДЫе§ШЗбЁЯюЮЊA CЁЃЃЈ4ЃЉNa2CO3ШмвКгыCaCl2ШмвКЗДгІЕФРызгЗНГЬЪНЮЊЃКCa2+ + CO32- == CaCO3Ё§Яђ2 mL NaHCO3ШмвКжаЕЮМг1 mL 0.5 molЁЄL-1CaCl2ШмвКЃЌВњЩњАзЩЋГСЕэКЭЦјЬхЁЃИУЬѕМўЯТЃЌNaHCO3ШмвКгыCaCl2ШмвКЗДгІЕФРызгЗНГЬЪНЮЊCa2+ + 2HCO3- === CaCO3Ё§+ CO2Ёќ+ H2OЁЃ
Na2CO3 + CO2Ёќ+ H2OЁЃЃЈ2ЃЉдкЯрЭЌЕФЮТЖШЯТЃЌдкЯрЭЌжЪСПЕФЫЎдкМгШыЯрЕШжЪСПЕФNa2CO3гыNaHCO3ЁЃНсЙћЗЂЯжNa2CO3ЙЬЬхЭъШЋШмНтЃЌЖјNaHCO3ЙЬЬхгаЪЃгрЫЕУїдкЯрЭЌЕФЮТЖШЯТNa2CO3БШNaHCO3ИќШнвзШмНтгкЫЎжаЁЃЂкЪЂЗХNa2CO3ЕФЩеБжаГіЯжЕФЯжЯѓЪЧМгЫЎШмНтЗХГіШШСПЪЙШмвКЕФЮТЖШЩ§ИпЃЌЕЮМгЗгЬЊЪдвККѓШмвКБфЮЊКьЩЋЃЌЫЕУїШмвКЯдМюадЁЃЫљвде§ШЗбЁЯюЮЊB DЁЃЃЈ3ЃЉЂйСНЪдЙмжаОљВњЩњЦјЬхЂёжаВњЩњЦјЬхИќПьЃЌЫљвдЂёЕФЗДгІГЬЖШИќЮЊОчСвЁЃЗЂЩњЕФЗДгІЮЊЃКNaHCO3+HCl=NaCl+H2O+ CO2Ёќn(NaHCO3) ЃКn(HCl)=1:1ЃЌ n(NaHCO3)=1/84mol=0.012mol<n(HCl)=0.003mol,ЫљвдЗХГіЕФЦјЬхЬхЛ§АДеебЮЫсРДМЦЫуЁЃNa2CO3+ 2HCl=2NaCl+H2O+ CO2Ёќn(Na2CO3) ЃКn(HCl)=1:2ЃЛn(Na2CO3)= 1/106mol= 0.009mol>2n(HCl)ЁЃЫљвдЗХГіЕФЦјЬхЕФЬхЛ§АДеебЮЫсРДМЦЫуЁЃвђЮЊЬМЫсФЦгыбЮЫсЗДгІЗжВННјааЃЌЕквЛВНВњЩњЬМЫсЧтФЦКЭТШЛЏФЦЃЌУЛгаЦјЬхЃЌЕкЖўВНВХЗХГіЦјЬхЃЌВЂЧвгыNa2CO3КЭNaHCO3ЗжБ№МгШыЕФбЮЫсЕФЬхЛ§ЯрЕШЃЌЫљвдЗХГіЦјЬхЕФЬхЛ§NaHCO3ЖрЁЃвђДЫе§ШЗбЁЯюЮЊA CЁЃЃЈ4ЃЉNa2CO3ШмвКгыCaCl2ШмвКЗДгІЕФРызгЗНГЬЪНЮЊЃКCa2+ + CO32- == CaCO3Ё§Яђ2 mL NaHCO3ШмвКжаЕЮМг1 mL 0.5 molЁЄL-1CaCl2ШмвКЃЌВњЩњАзЩЋГСЕэКЭЦјЬхЁЃИУЬѕМўЯТЃЌNaHCO3ШмвКгыCaCl2ШмвКЗДгІЕФРызгЗНГЬЪНЮЊCa2+ + 2HCO3- === CaCO3Ё§+ CO2Ёќ+ H2OЁЃ
ПМЕуЃКПМВщNa2CO3КЭNaHCO3ЕФаджЪЕФжЊЪЖЁЃ


 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2016НьеуНЪЁИпвЛЩЯбЇЦкЕквЛДЮжЪМьЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
НЋБъзМзДПіЯТЕФV LHClЃЈЦјЃЉШмгк1000gЫЎжаЃЌЕУЕНЕФбЮЫсУмЖШЮЊ?g/cm3ЃЌдђИУбЮЫсЕФЮяжЪЕФСПХЈЖШЮЊЃЈ ЃЉ
AЃЎ BЃЎ
BЃЎ
CЃЎ DЃЎ
DЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2016НьКгФЯЪЁзЄТэЕъЪаИпвЛЩЯбЇЦкЫФаЃСЊПМЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
ВЛФмгУХХЫЎЗЈЪеМЏЕФЦјЬхЪЧ( )
AЃЎH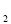 BЃЎO
BЃЎO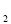 CЃЎNO
CЃЎNO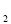 DЃЎNO
DЃЎNO
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2016НьКгФЯЪЁф№КгЪаЮхаЃИпвЛЩЯбЇЦкЦкжаСЊПМЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
ЯТСаШмвКжаClЃХЈЖШгы50 mL 1 molЁЄL-1 AlCl3ШмвКжаClЃХЈЖШЯрЕШЕФЪЧ
AЃЎ150 mL 1 molЁЄL-1ЕФNaClШмвК BЃЎ75 mL 2 molЁЄL-1 NH4ClШмвК
CЃЎ150 mL 2 molЁЄL-1ЕФKClШмвК DЃЎ75 mL 1 molЁЄL-1ЕФFeCl3ШмвК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2016НьКгФЯЪЁф№КгЪаЮхаЃИпвЛЩЯбЇЦкЦкжаСЊПМЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
ЯТСаЪЕбщВйзїе§ШЗЕФЪЧ
AЃЎГЦСПNaOHЙЬЬхЪБЃЌНЋЦфЗХШыЭаХЬЬьЦНзѓХЬЕФжНЩЯ
BЃЎеєЗЂНсОЇЪБгІНЋШмвКеєИЩ
CЃЎЗжвКТЉЖЗЪЙгУЧАвЊМьбщЫќЪЧЗёТЉЫЎ
DЃЎгУОЦОЋнЭШЁЕтЫЎжаЕФЕт
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2016НьКгФЯЪЁТхбєЪаИпвЛЩЯбЇЦкЦкФЉМьВтЛЏбЇЪдОэЃЈAЃЉЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
ЙигкЙшМАЦфЛЏКЯЮяЕФа№ЪіжаЃЌВЛе§ШЗЕФЪЧ
AЃЎЙшЪЧСМКУЕФАыЕМЬхВФСЯ
BЃЎЖўбѕЛЏЙшФмгыЪЏЛвЪЏЗДгІЃКSiO2ЃЋCaCO3 CaSiO3ЃЋCO2Ёќ
CaSiO3ЃЋCO2Ёќ
CЃЎПЩвдгУНЙЬПЛЙдЖўбѕЛЏЙшЩњВњЙшЃКSiO2 ЃЋ 2C  Si ЃЋ 2COЁќ
Si ЃЋ 2COЁќ
DЃЎЫЎФрЕФжївЊГЩЗжЪЧ Na2SiO3ЁЂCaSiO3 КЭ SiO2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2016НьКгФЯЪЁТхбєЪаИпвЛЩЯбЇЦкЦкФЉМьВтЛЏбЇЪдОэЃЈAЃЉЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
ЩшNAБэЪОАЂЗќМгЕТТоГЃЪ§ЃЌЯТСаа№Ъіжае§ШЗЕФЪЧ
AЃЎБъзМзДПіЯТЃЌ2.24 L CCl4ЫљКЌЕФдзгЪ§ЮЊ0.5 NA
BЃЎ100 m L 0.1 mol/LЕФ NaCl ШмвКжаЃЌЫљКЌЮЂСЃзмЪ§ЮЊ0.02 NA
CЃЎ1.7 g ЕФOHЃжаКЌгаЕФЕчзгЪ§ЮЊNA
DЃЎ78 g Na2O2 гызуСПЫЎЗДгІзЊвЦЕчзгЪ§ЮЊ2 NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2016НьКгФЯЪЁТхбєЪаИпвЛЩЯбЇЦкЦкжаПМЪдЛЏбЇЪдОэЃЈAОэЃЉЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
вбжЊСђЫсШмвКЕФжЪСПЗжЪ§дНДѓЪБЃЌЦфШмвКЕФУмЖШдНДѓЃЌНЋ80%КЭ20%ЕФСНжжH2SO4ШмвКЕШЬхЛ§ЛьКЯКѓЃЌШмвКЕФжЪСПЗжЪ§ЮЊ( )
AЃЎДѓгк50% BЃЎЕШгк50% CЃЎаЁгк50% DЃЎЮоЗЈШЗЖЈ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2016НьКгФЯЪЁдУћаЃИпвЛЩЯбЇЦкЦкФЉСЊПМЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКбЁдёЬт
бѕЛЏЛЙдЗДгІжаЃЌЫЎЕФзїгУПЩвдЪЧбѕЛЏМСЁЂЛЙдМСЁЂМШЪЧбѕЛЏМСгжЪЧЛЙдМСЁЂМШЗЧбѕЛЏМСгжЗЧЛЙдМСЕШЁЃЯТСаЗДгІгыBr2+SO2+2H2O=H2SO4+2HBrЯрБШНЯЃЌЫЎЕФзїгУВЛЯрЭЌЕФЪЧ
AЃЎ2Na2O2+2H2O =4NaOH+O2Ёќ BЃЎCl2 + H2O  HClO + HCl
HClO + HCl
CЃЎ2F2+2H2O=4HF+O2 DЃЎ4FeЃЈOHЃЉ2+O2+2H2O=4FeЃЈOHЃЉ3
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com