
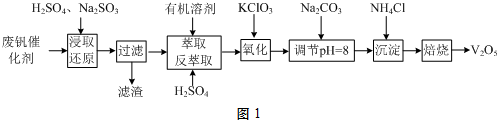
分析 废钒催化剂(含有V2O5、VOSO4及SiO2等,其中VOSO4可溶于水),废钒催化剂粉碎、加硫酸、亚硫酸钠浸取,亚硫酸钠具有还原性,能将V2O5还原为VOSO4,发生反应:V2O5+SO32-+4H+=2VO2++SO42-+2H2O,将溶解性物质溶于水,然后过滤得到滤渣和滤液,滤渣中含有SiO2等不溶性杂质,将滤液中加入氯酸钾,氯酸钾具有氧化性,能将VOSO4氧化为(VO2)2SO4,调节溶液pH为8且采用离子交换方法得到VO3-,向溶液中加入氯化铵,得到难溶性的NH4VO3,焙烧NH4VO3得到V2O5.
(1)萃取、反萃取过程中,需要烧杯、分液漏斗等仪器;
(2)①“浸取还原”过程的产物为VOSO4,据流程图和氧化还原剂原理,可写出反应的离子方程式;
②“氧化”过程无气体产生,溶液中VO2+转化为VO2+,氯元素化合价从+5→-1,根据得失电子守恒和原子守恒书写离子方程式;
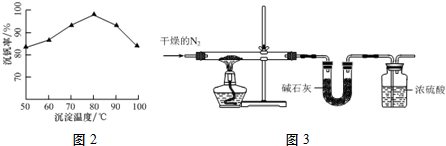
(3)沉钒率受温度、氯化铵系数(NH4Cl的质量与调节pH之后的料液中VO3-的质量比)等的影响,根据图2分析坐标系中的表示含义,结合图中的沉矾率在80度C时最大,约为98%,温度高于80度,导致部分氯化铵分解;
(4)①图3干燥的氮气驱赶装置中的空气,碱石灰吸收产物水,浓硫酸吸收产物氨气;
②根据n=$\frac{m}{M}$计算出该沉淀的物质的量,得到的残留固体为V2O5,碱石灰吸收的为水、浓硫酸吸收的为氨气,根据题中数据计算出各分解产物的物质的量,再得出该沉淀的化学式即可.
解答 解:(1)萃取、反萃取过程中,需要烧杯、分液漏斗等仪器,主要玻璃仪器为分液漏斗,
故答案为:分液漏斗;
(2)①浸取还原过程的产物之一是VOSO4,V化合价为+4,据是还原过程可得原反应物是更高价的V,即为V2O5,反应的化学方程式为:Na2SO3+V2O5+2H2SO4=2VOSO4+Na2SO4+2H2O,离子反应方程式为:V2O5+SO32-+4H+=2VO2++SO42-+2H2O,
故答案为:V2O5+SO32-+4H+=2VO2++SO42-+2H2O;
②氯元素化合价从+5→-1,化合价降低6,钒化合价从+4→+5,化合价升高1,二者最小公倍数为6,把变价元素配平,初步配平为:ClO3-+6VO2++H2O→6VO2++Cl-+H+,根据氧原子守恒确定H2O前系数为3,氢离子前系数为6,故配平后为:6VO2++ClO3-+3H2O=6VO2++Cl-+6H+,
故答案为:6VO2++ClO3-+3H2O=6VO2++Cl-+6H+;
(3)沉钒率受温度、氯化铵系数(NH4Cl的质量与调节pH之后的料液中VO3-的质量比)等的影响,根据图示2分析数据,80℃时沉矾率最高为98%,温度高于80度,导致部分氯化铵分解,所以温度高于80℃沉钒率降低,
故答案为:温度高于80度,导致部分氯化铵分解;
(4)①沉淀为一系列的聚合物种[其分子组成可用NmHnVxOy表示],取该沉淀83.2g,加热,产生氨气、水、五氧化二钒,图3干燥的氮气驱赶装置中的空气,碱石灰吸收产物水,浓硫酸吸收产物氨气,
故答案为:吸收产生的氨气;
②n(沉淀)=83.2g÷832g/mol=0.1mol,由题意知沉淀分解生成H2O、NH3和V2O5,n(H2O)=3.6g÷18g/mol=0.2mol,n(NH3)=(83.2g-72.8g-3.6g)÷17g/mol=0.4mol,n(V2O5)=72.8g÷182g/mol=0.4moln(沉淀):n(H2O):n(NH3):n(V2O5)=1:2:4:4,因此该物质的分子式为N4H16V8O22,
故答案为:N2H16V8O22.
点评 本题考查了回收钒的新工艺,侧重考查利用信息进行判断和书写方程式的能力,图象分析能力,提取钒元素的流程分析和氧化还原反应的应用,明确各个过程发生的反应及基本操作方法是解本题关键,题目难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:解答题
 以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:
以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na2S2O3是重要的化工原料,易溶于水.在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水.在中性或碱性环境中稳定.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阅读下列实验内容,根据题目要求回答问题:
阅读下列实验内容,根据题目要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用滴定管时,滴定管必须用待装液润洗2~3次 | |
| B. | 酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液 | |
| C. | 盛放准确量取待测液的锥形瓶应预先用待测液润洗 | |
| D. | 滴定操作应重复2至3次,并求出滴定用去的溶液体积的平均值,计算出待测液的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
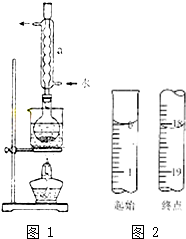
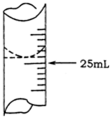 欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:| 实验序号 | 待测NaOH溶液的体积/mL | HCl标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.10 |
| 2 | 25.00 | 1.50 | 21.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该反应属于取代(填“取代”或“加成”)反应.
,该反应属于取代(填“取代”或“加成”)反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com