
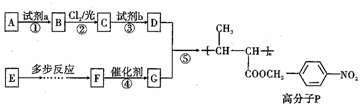
 ,试剂a是浓硫酸和浓硝酸.
,试剂a是浓硫酸和浓硝酸. +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$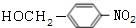 +NaCl.
+NaCl.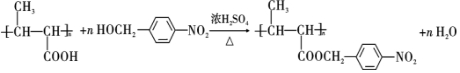 .
.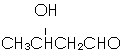 ,以E为起始原料.选用必要的无机试剂合成F,写出合成路线
,以E为起始原料.选用必要的无机试剂合成F,写出合成路线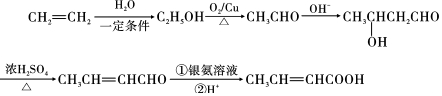 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件). 分析 A为芳香烃,其核磁共振氢谱显示有4组峰,其峰面积之比为3:2:2:1,结合P的结构简式,可知A的结构简式是 ,A与浓硝酸在浓硫酸、加热条件下发生取代反应生成B为
,A与浓硝酸在浓硫酸、加热条件下发生取代反应生成B为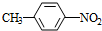 ,B与氯气在光照条件下发生取代反应生成C为
,B与氯气在光照条件下发生取代反应生成C为 ,C在氢氧化钠水溶液、加热条件下发生水解反应生成D为
,C在氢氧化钠水溶液、加热条件下发生水解反应生成D为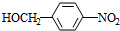 ,可知G的结构简式为
,可知G的结构简式为 ,则F为CH3CH=CHCOOCH2CH3,E的产量可用来衡量一个国家石油化工发展的水平,则E为CH2=CH2,以此解答(1)~(5);
,则F为CH3CH=CHCOOCH2CH3,E的产量可用来衡量一个国家石油化工发展的水平,则E为CH2=CH2,以此解答(1)~(5);
(6)以E为起始原料.选用必要的无机试剂合成F,则乙烯与水加成生成乙醇,乙醇氧化生成乙醛、乙醛发生信息中的反应生成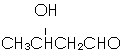 ,再发生消去反应、最后银镜反应氧化-CHO生成-COOH,以此来解答.
,再发生消去反应、最后银镜反应氧化-CHO生成-COOH,以此来解答.
解答 解:(1)A的分子式是C7H8,其结构简式是 ,试剂a是:浓硫酸和浓硝酸,
,试剂a是:浓硫酸和浓硝酸,
故答案为: ;浓硫酸和浓硝酸;
;浓硫酸和浓硝酸;
(2)反应③的化学方程式为 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl,
+NaCl,
故答案为: +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl;
+NaCl;
(3)F为CH3CH=CHCOOCH2CH3,官能团名称为碳碳双键、羧基,故答案为:碳碳双键、羧基;
(4)反应④为碳碳双键发生加聚反应,故答案为:加聚反应;
(5)反应⑤的化学方程式是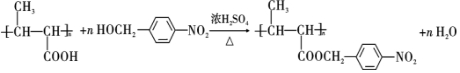 ,
,
故答案为: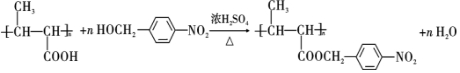 ;
;
(6)以E为起始原料.选用必要的无机试剂合成F,则乙烯与水加成生成乙醇,乙醇氧化生成乙醛、乙醛发生信息中的反应生成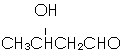 ,再发生消去反应、最后银镜反应氧化-CHO生成-COOH,合成流程为
,再发生消去反应、最后银镜反应氧化-CHO生成-COOH,合成流程为 ,
,
故答案为: .
.
点评 本题考查有机物的合成,为高频考点,把握合成流程中官能团的变化、碳链变化、有机反应为解答的关键,侧重分析与推断能力的考查,注意有机物性质的应用,题目难度不大.


 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. | 医用酒精的浓度通常为95% | |
| B. | Y(C2H5OH),W(C2H5ONa)可通过消去反应由Y得到W | |
| C. | 实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 | |
| D. | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去,使溶液褪色的气体只是乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取25.00mL蒸馏水 | B. | 用分液漏斗分离乙醇和水 | ||
| C. | 用烧杯溶解FeCl3试样 | D. | 用托盘天平称量NaCl固体5.80g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
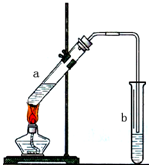 用如图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空:
用如图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [M+]>[OH-]>[A-]>[H+] | B. | [M+]>[A-]>[H+]>[OH-] | C. | [M+]>[A-]>[OH-]>[H+] | D. | [M+]>[H+]=[A-]>[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
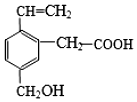 某有机物的结构如图所示,这种有机物不可能具有的性质是( )
某有机物的结构如图所示,这种有机物不可能具有的性质是( )| A. | 只有⑥ | B. | ①④ | C. | ⑤⑥ | D. | ④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com