
| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | 元素周期律是元素原子核外电子排布周期性变化的结果 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |
分析 A.离子键中阴阳离子间既存在静电吸引力也存在原子核间的排斥力;
B.原子的结构决定着元素的性质,元素周期律是元素原子核外电子排布周期性变化的结果;
C.同一周期,从左到右最高价氧化物对应水化物的酸性越强,必须指出最高化合价;
D.HF、HCl、HBr、HI的还原性依次增强.
解答 解:A.形成离子键的阴阳离子间既存在静电吸引力也存在原子核间的排斥力,故A错误;
B.原子的结构决定着元素的性质,最外层电子的排布呈规律性变化,则性质呈周期性变化,故B正确;
C.第三周期从左到右,元素的非金属逐渐增强,最高价氧化物对应水化物的酸性越强,但含氧酸的酸性没有此递变规律,故C错误;
D.非金属性越强,氢化物的稳定性越强,而阴离子的还原性越弱,则HF、HCl、HBr、HI的热稳定性依次减弱,但还原性依次增强,故D错误;
故选B.
点评 本题考查了离子键、元素周期律的应用,题目难度不大,明确元素周期律的内容为解答关键,A为易错点,注意离子键中既存在静电吸引力也存在原子核间的排斥力.


科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O | B. | NaOH | C. | AgNO3 | D. | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15g甲基(-CH3)所含有的电子数是10 NA个 | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA个 | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 | |
| D. | 4.2g C3H6中含有的碳碳双键数一定为0.1N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3 | B. | Mg(OH)2和Al(OH)3 | C. | Mg(OH)2 | D. | MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、NH4+、CO32- | B. | Fe3+、Cl-、NO3- | C. | Na+、OH-、HCO3- | D. | Al3+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用核磁共振氢谱图可以鉴别乙醇和溴乙烷,该方法是物理方法 | |
| B. | 乙烯、苯、乙醇均能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇可以转化成乙醛,乙醇和乙醛都能发生加成反应 | |
| D. | 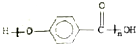 的结构中只含有羟基和羧基 的结构中只含有羟基和羧基 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
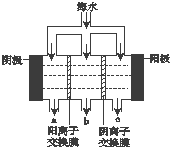 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com