
将一块铜板浸泡在一定浓度的FeCl3溶液中一段时间后取出,得到一混合溶液,某校化学兴趣小组的同学为分析该混合溶液的组成,进行了如下实验:
Ⅰ、取50.0 mL混合溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为86.1 g;
Ⅱ、另取50.0 mL混合溶液,向其中加入1.40 g铁粉,结果铁粉全部溶解但未见固体析出;
Ⅲ、再取50.0 mL混合溶液,向其中加入20.0 mL稀硝酸,到一种无色气体,其体积换算成标准状况时为0.448 L;
请根据以上实验中得到的数据分析计算:
(1)原FeCl3溶液物质的量浓度(反应过程中过程中溶液体积的变化忽略不计);
(2)所得混合溶液中c(Cu2+)的取值范围;
(3)若要进一步求得混合溶液中c(Cu2+)的具体数值,在只单独使用AgNO3溶液、铁粉或稀硝酸的前题下,还可测出哪些数据,必须进行哪些实验?
(1)解:由I得50.0 mL混合溶液中c(Cl-)=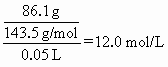
所以原FeCl3溶液中c(FeCl3)=![]() (2分)
(2分)
(2)解:Ⅱ中加入1.4 g Fe无固体剩余,即发生的反应为:Fe+2Fe3+=3Fe2+
所以50.0 mL混合溶液中至少含有Fe3+:![]() (1分)
(1分)
Ⅲ中加入20.0 mL稀硝酸后产生的气体为NO,反生的反应为
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
即50.0 mL混合溶液中至少含有Fe2+:![]() (1分)
(1分)
50.0 mL混合溶液中根据铁元素守恒有:
n(Fe2+)+n(Fe3+)=4.0 mol/L×0.05 L=0.20 mol
根据电荷守恒有:
3n(Fe3+)+2n(Fe2+)+2n(Cu2+)=n(Cl-)=![]()
当n(Fe3+)有最小值时,n(Fe2+)、n(Cu2+)有最大值,且由上述两等式可求得
n(Cu2+)的最大值为0.075 mol(2分)
当n(Fe2+)有最小值时,n(Fe3+)有最大值,n(Cu2+)有最小值,同样可求得
n(Cu2+)的最小值为0.03 mol(2分)
所以,50.0 mL混合溶液中n(Cu2+)的取值范围为:[0.600 mol/L,1.50 mol/L]
(3)解:还可测出50.0 mL混合溶液中n(Fe2+)的值,应进行的实验是向50.0 mL混合溶液中加入足量的稀硝酸,测出生成的气体体积(标准状况).(2分)


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com