

| A. | X的能量一定高于M | B. | 正反应为吸热反应 | ||
| C. | 该反应一定要加热后才能发生 | D. | 反应物总能量高于生成物总能量 |
分析 根据图象可知,反应物的总能量小于生成物的总能量,可知反应吸热,正反应为吸热反应则逆反应为放热反应,据此解答.
解答 解:根据图象可知,反应物的总能量小于生成物的总能量,可知反应吸热,正反应为吸热反应则逆反应为放热反应,
A、从图上可知,X和Y具有的总能量小于M具有的总能量,不能判断X和M的能量关系,故A错误;
B、根据图象可知,反应物的总能量小于生成物的总能量,可知反应吸热,故B正确;
C、吸放热反应与反应条件无关,故C错误;
D、从图上可知,反应物具有的总能量小于生成物具有的总能量,故D错误;
故选:B.
点评 本题考查吸热反应的图象分析,注意正逆反应的焓变是相反数、焓变是反应物能量和与生成物能量和的差值,题目难度不大.


科目:高中化学 来源: 题型:解答题
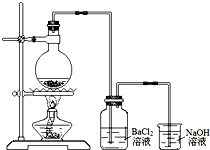 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).
A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子组成中相差一个或几个CH2 原子团的有机物是同系物 | |
| B. | 各组成元素质量分数相同的烃是同一种烃 | |
| C. | 分子式相同而结构不同的有机物不一定是同分异构体 | |
| D. | 互为同系物的有机物其分子结构必然相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z>W | B. | 金属性:X<Y,还原性:W 2->Z- | ||
| C. | 原子最外层电子数:Y>X>Z>W | D. | 原子序数:Y>X>Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量铁粉加入稀盐酸中:Fe+2H+=Fe2++H2↑ | |
| B. | Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| C. | NH4HCO3溶液和过量Ba(OH)2溶液共热:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O | |
| D. | 重铬酸钾溶液中:Cr2O72-+H2O?2CrO42-+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com