
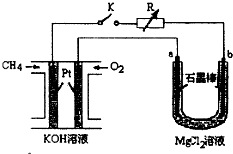
 ����Ч�ļ���ȼ�ϵ�ز��ò�Ϊ�缫���ϣ����缫�Ϸֱ�ͨ�� CH4�� O2�������Ϊ KOH ��Һ��ij�о�С�齫����ȼ�ϵ� ����Ϊ��Դ�����Ȼ�þ��Һ���ʵ�飬���װ����ͼ��ʾ��
����Ч�ļ���ȼ�ϵ�ز��ò�Ϊ�缫���ϣ����缫�Ϸֱ�ͨ�� CH4�� O2�������Ϊ KOH ��Һ��ij�о�С�齫����ȼ�ϵ� ����Ϊ��Դ�����Ȼ�þ��Һ���ʵ�飬���װ����ͼ��ʾ��
| ||
| ||
| 1.12L |
| 22.4L/mol |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��K | B��Ca | C��Cl | D��Ne |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ʱ��/Ũ�� | c��NH3����mol/L�� | C��O2����mol/L�� | C��NO����mol/L�� |
| ��ʼ | 0.8 | 1.5 | 0 |
| ��2min | 0.7 | a | 0.1 |
| ��4min | 0.4 | 1.0 | 0.4 |
| ��6min | 0.4 | 1.0 | 0.4 |
| ��8min | 1.2 | 2.5 | 0.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
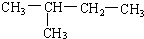
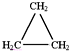
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ʢ���ռ���Լ�ƿ�����ò�������SiO2+2NaOH=Na2SiO3+H2O |
| B����ҵ��FeCl3��Һ��ʴͭ��·�壺Fe3++Cu=Fe2++Cu2+ |
| C������KI������Һ���ú������4I-+O2+2H2O=2I2+4OH- |
| D��ʳ������ˮ����ů����ˮ����������е�ˮ����2H++CaCO3=Ca2++H2O+CO2�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com