
【题目】CO(g)+H2O(g)![]() H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,下列说法正确的是
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,下列说法正确的是
A.改变压强,平衡不发生移动,反应放出的热量不变
B.加入催化剂,改变了反应的途径,反应的△H也随之改变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
科目:高中化学 来源: 题型:
【题目】以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
I.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
V.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)简述由硫酸亚铁晶体得到FeSO4·7H2O的主要操作步骤:___________________。
(2)Ⅱ中,需加一定量硫酸。同理,配制硫酸铝溶液时也需加入一定量的硫酸,请说出加入硫酸的作用,并写出相关的离子方程式:________________________。
(3)Ⅲ中,生成FeCO3的离子方程式是 ____________________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是____________________。
(4)IV中为什么用90℃热水洗涤沉淀?____________________。
(5)已知煅烧FeCO3的化学方程式是4 FeCO3+O2![]() 2Fe2O3+4CO2。现煅烧 464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则用氧气将这些FeO氧化需要标况下氧气的体积是_________L。
2Fe2O3+4CO2。现煅烧 464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则用氧气将这些FeO氧化需要标况下氧气的体积是_________L。
(摩尔质量/g·mol-1:FeCO3:116g·mol-1;Fe2O3:160g·mol-1;FeO:72g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取5等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g)![]() N2O4(g),△H<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是( )
N2O4(g),△H<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是( )

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于油脂的叙述中,不正确的是( )
A.油脂没有固定的熔点和沸点,油脂是混合物
B.天然油脂大多是由混甘油酯分子构成的混合物
C.油脂的主要成分是高级脂肪酸的甘油酯,是酯的一种
D.油脂的水解叫皂化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,依次属于酸、盐、碱、非电解质的一组是( )
A.硫酸 硫酸铜 纯碱 干冰
B.硝酸 硝酸银 熟石灰 干冰
C.碳酸 纯碱 食盐 冰
D.醋酸 食盐 烧碱 铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L﹣1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
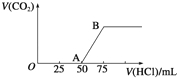
A.OA段所发生反应的离子方程式:H++OH﹣═H2O;CO32﹣+H+═HCO3-
B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
C.产生的CO2体积(标准状况下)为0.056 L
D.原NaOH溶液的物质的量浓度为0.5 mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在任何条件下,纯水显中性,这是因为
A.pH=7 B.c(H +)=c(OH -)
C.c(H+)=c(OH-)=10-7mol·L-1 D.c(H +)×c(OH-)=10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】椰树牌天然矿泉水的成分:含钠46.31g/L 、含钙35.11g/L 、含碘0.051g/L……,这里所标成分钠、钙、碘指的是
A. 元素 B. 单质 C. 原子 D. 氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。

请回答下列问题:
(1)用化学式表示:丙为 ,H为 。
(2)A的电子式为 。
(3)写出B+C→D的化学方程式 。
写出E+G→F的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com