
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
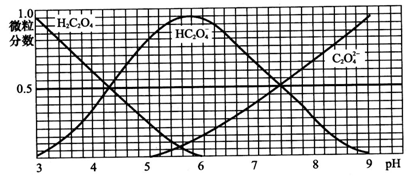
 如图表示的是25℃时,难溶氢氧化物在不同pH下的溶解度(S/mol?L-1,假定该浓度为饱和溶液中阳离子的浓度).
如图表示的是25℃时,难溶氢氧化物在不同pH下的溶解度(S/mol?L-1,假定该浓度为饱和溶液中阳离子的浓度).| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com