
| A、35.5aV2=W2-W1 |
| B、n(Al)<W1/50 |
| C、n(Na)+3n(Al)=2V1/22.4 |
| D、aV2=n(Na)+3n(Al) |
| w1 |
| 50 |
| 1 |
| 2 |
| 3 |
| 2 |
| V1 |
| 22.4 |
| V1 |
| 11.2 |


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
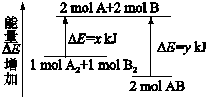
| A、该反应是吸热反应 |
| B、断裂2 mol A-B键需要吸收y kJ的能量 |
| C、2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
| D、断裂1 mol A-A键和1 mol B-B键能放出x kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时下层液体从分液漏斗下端放出,上层液体从上口倒出 |
| B、酸碱滴定实验中,酸式滴定管装液前不必先用待装溶液润洗 |
| C、蒸馏过程中,冷却水从冷凝管的上端通入 |
| D、配制一定物质的量浓度的溶液时,直接将称取的固体药品倒入容量瓶加水溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质物质的量(mol) | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热 23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q (Q>0) |
| A、容器①、②中反应的平衡常数相等 |
| B、达平衡时,两个容器中XY3的物质的量浓度均为2 mol?L-1 |
| C、容器②中反应达到平衡时放出的热量为Q=23.15 kJ |
| D、若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
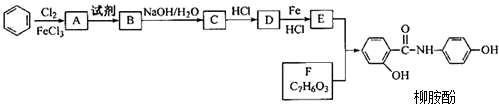
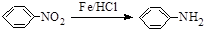 .请回答下列问题:
.请回答下列问题: 的化学方程式
的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2O(g)=H2(g)+
| ||
| B、2H2O(l)=2H2(g)+O2(g)△H=+571.6 kJ?mol-1 | ||
C、H2(g)+
| ||
| D、2H2(g)+O2=2H2O(g)△H=-483.6 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 室温时,向20mL 0.1mol?L-1的醋酸溶液中不断滴入0.1mol?L-1的NaOH溶液,溶液的pH变化曲线,如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL 0.1mol?L-1的醋酸溶液中不断滴入0.1mol?L-1的NaOH溶液,溶液的pH变化曲线,如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )| A、a点时:c ( CH3COOH )>c ( Na+)>c ( CH3COO-)>c ( H+)>c ( OH -) |
| B、b点时:c ( Na+)=c ( CH3COO-)>c ( H+)=c ( OH-) |
| C、c点时:c ( OH-)=c ( CH3COOH )+c ( H+) |
| D、d点时:c ( Na+)>c ( CH3COO-)>c (OH-)>c ( H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com