
X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质。Z是地壳中含量最高的金属元素;而地壳中含量最高的非金属元素与X同主族、与Y同周期。
(1)实验室用H2XO4制取XO2气体的化学反应方程式为 。(请用具体元素符号表示化学式,下同)
(2)t℃时,0.1 mol·L-1的NaHXO3溶液pH=6,该溶液中各离子浓度由大到小顺序排列为 。
(3)请写出Z的氧化物与烧碱溶液反应的离子方程式 。
(4)一定条件下,YO与YO2存在下列反应:YO(g)+ YO2(g)  Y2O3(g),其平衡常数表达式为K= 。
Y2O3(g),其平衡常数表达式为K= 。
(5)工业上用氧化YH3法制取YO,该反应的热化学方程式为:
4YH3(g)+5O2(g)=4YO(g)+6H2O(g) △H=-905.8kJ·mol-1;
已知Y2(g)+O2(g)=2YO(g) △H="+180" kJ·mol-1,则YH3与氧气反应产生两种无污染物质的热化学式为 。
(1)Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
〔或2H2SO4(浓)+ Cu  CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
或2H2SO4(浓)+ S  3SO2↑+ 2H2O等合理答案〕(3分)
3SO2↑+ 2H2O等合理答案〕(3分)
(2)c(Na+)、c(HSO3-)、c(H+)、c(SO32-)、c(OH-)(2分)
(3)Al2O3+2OH-=2AlO2-+H2O(3分)
(4)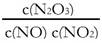 (2分)
(2分)
(5)4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1265.8kJ·mol-1(3分)
解析试题分析:与酸雨有关的两种氧化物为二氧化硫和氮的氧化物,X元素的原子序数大于Y,故XY分别为S和N,Z为Al。(1)实验室中一般用浓硫酸和Na2SO3反应或与铜反应制取二氧化硫;(2)NaHSO3溶液存在HSO3-的电离和水解平衡,根据溶液为酸性,确定以电离为主,故由大到小的顺序为c(Na+)、c(HSO3-)、c(H+)、c(SO32-)、c(OH-);(5)①-②×2得出对应热化学方程式4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1265.8kJ·mol-1
考点:考查物质结构、热化学方程式书写、离子浓度大小比较等有关问题。


科目:高中化学 来源: 题型:填空题
A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。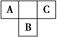
(1)A、B、C三种元素的名称分别为________、________、________。
(2)B位于元素周期表中第______周期,第________族。
(3)C的原子结构示意图为________,C的单质与H2反应的化学方程式为_________________________________________________________________。
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为: ,B最外层电子数是2,C的气态氢化物的水溶液呈碱性,据此填空:
,B最外层电子数是2,C的气态氢化物的水溶液呈碱性,据此填空:
(1)A的元素名称为________,其气态氢化物的稳定性比CH4________(填“强”或“弱”)。
(2)C、D的最高价氧化物的水化物的酸性大小为________>________(填化学式)。
(3)B的活泼性比钙的________(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的次外层电子数比最外层电子数多4个,E元素原子最外层与最内层电子数的差是3,试回答:
(1)写出下列元素的元素符号:A__________,C________,D__________,E__________。
(2)用电子式表示B和F形成化合物的过程:__________。
(3)写出A、C、F三种元素最高价氧化物的水化物相互反应的化学方程式__________________,__________________,________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D四种元素,A的最高正价与其负价的绝对值之差为6;A、D次外层都是8个电子,A与D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子;B有两个电子层,其最高正价与最低负价的代数和为零;C2-与氩原子具有相同的电子层结构。
(1)试写出上述各元素的符号:
A________,B________,C________,D________。
(2)画出下列粒子的结构示意图:
A_________________,C2-_________________。
(3)写出A、D的最高价氧化物对应水化物反应的化学方程式:__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
(1)A原子核外比X原子多3个电子,A的原子结构示意图是________;含1 mol X的氧化物晶体中含有共价键数目为________。
(2)Z与钙离子组成的化合物的电子式为________________。
(3)14 g Y完全燃烧放出的热量是141.5 kJ,写出Y燃烧的热化学方程式:______________________________。
(4)组成W的元素最高价氧化物对应的水化物甲有下图所示转化关系(反应条件和其他物质已略):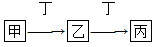
①写出丁在高温下与水反应的化学方程式:__________________;
②组成W的元素的简单氢化物极易溶于水的主要原因是________________________
该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
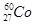 的衰变方程式为
的衰变方程式为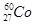 =
=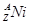 +
+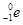 +Ve,其中Ve是反中微子,它的电荷为零,静止质量可以为零。
+Ve,其中Ve是反中微子,它的电荷为零,静止质量可以为零。
(1)下列关于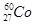 的叙述中,错误的是________(填序号)。
的叙述中,错误的是________(填序号)。
A.质子数是27 B.电子数是27
C.质量数是27 D.中子数是60
(2)在上述衰变方程中,衰变产物Ni的质量数A为______,核电荷数Z为________。
(3)元素的化学性质主要取决于________(填序号)。
A.最外层电子数 B.核内中子数
C.核内质子数 D.质量数不同
(4)不同种元素的本质区别是________(填序号)。
A.质子数不同 B.中子数不同
C.电子数不同 D.质量数不同
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置__________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)______。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________________________________________________________________________。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________________________________。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________________________________________________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
W、X、Y、Z是元素周期表中原子前四周期的四种元素,有关它们的信息如下表所示。
| 元素 | 相关信息 |
| W | W的基态原子L层电子数是K层电子数的3倍 |
| X | X与氢元素形成的一种化合物可以使湿润的红色石蕊试纸变蓝 |
| Y | 单质为黄绿色气体,最高价氧化物对应的水化物化学式为HYO4 |
| Z | Z的基态原子外围电子排布式为(n-1)d10ns1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com