
| △n |
| △t |
| 2 |
| 3 |
| 2 |
| 3 |
| △c(X) |
| △t |
| ||
| 2min |
| 5 |
| 6 |
| 5 |
| 6 |
| △n(Y) |
| V |
| 0.25mol |
| 2L |
| 0.6mol |
| 2L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:知识精讲与能力训练 高三化学 题型:013
把0.6mol X气体和0.4mol Y气体混合于2L密闭容器中发生反应:3X(气)+Y(气)=nZ(气)+2W(气)5min末生成0.2mol W,若测知以Z浓度变化表示的反应平均速率为0.01mol·L-1·min-1,则:上述反应中化学计量数n值是
[ ]
查看答案和解析>>
科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高二化学(上) 题型:013
把0.6mol X气体和0.4mol Y气体混合于容积为2L的容器中,使其发生如下反应:3X(气)+Y(气)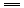 nZ(气)+2W(气).5min末生成0.2mol W,若测知以Z浓度变化表示的平均反应速率为0.01 mol/(L·min),则n的值为
nZ(气)+2W(气).5min末生成0.2mol W,若测知以Z浓度变化表示的平均反应速率为0.01 mol/(L·min),则n的值为
[ ]
|
A.1 |
B.2 |
|
C.3 |
D.4 |
查看答案和解析>>
科目:高中化学 来源:活题巧解巧练·高考化学(第一轮) 题型:013
把0.6mol X气体和0.4mol Y气体混合于2L容器中,使其发生如下反应:3X(气)+Y(气) nZ(气)+2W(气),5min末生成0.2mol W,若测得以Z浓度变化表示的平均反应速率为0.01mol/(L·min),则n的值为
nZ(气)+2W(气),5min末生成0.2mol W,若测得以Z浓度变化表示的平均反应速率为0.01mol/(L·min),则n的值为
[ ]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com