


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ǿ�������ˮ��Һ����ȫ��������������� |
| B������Һ�У���������ǿ�ĵ������ǿ����� |
| C����ͬһ���������˵������Һ���¶Ⱥ�Ũ�Ȳ�ͬʱ���䵼������Ҳ����ͬ |
| D��������ǿ�������Һ̬ʱ���еĵ��磬�еIJ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���ữѧʽ | CH3COOH | HCN | H2CO3 |
| ����ƽ�� ����(25 ��) | 1.8��l0��5 | 4.9��l0��10 | K1��4.3��l0��7 K2��5.6��l0��11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���� | HCOOH | HCN | H2CO3 |
| ����ƽ�� ����(25��) | Ki��1.77��10��4 | Ki��4.9��10��10 | Ki1��4.3��10��7 Ki2��5.6��10��11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������Һ������ʾ���ԡ����Ի����� |
| B�������Һ��һ������c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| C����a>b��������Һ��c(C1-)=c(NH4+)+c(NH3��H2O) |
D���������Һ�����ԣ���NH3��H2O�ĵ���ƽ�ⳣ��Ϊ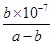 mol��L-1 mol��L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������¶�,��Һ��pH������ |
| B��������������NaOH,��Һ��c(CH3COO-)+c(OH-)>c(Na+)+c(H+) |
| C����������0.2 mol��L-1��������Һ,ˮ���������c(H+)��С |
| D����0.1 mol��L-1��NaOH��Һ�������Ϻ�,��Һ��c(CH3COO-)=c(Na+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A�������£���0.1 mol��L-1һԪ��BOH��Һ��pH=10������֪BOH��Һ���ڣ�BOH B++OH- B++OH- |
| B�������£�pH��7��NH4Cl�백ˮ�Ļ����Һ�У�c(Cl-)��c(NH4+)��c(H+)��c(OH-) |
| C���к�pH���������ͬ������ʹ�����Һ������NaOH�����ʵ�����ͬ |
| D����pH��4������ϡ�ͺ���Һ���������ӵ�Ũ�Ⱦ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 NH4+ +OH-�������м�������0.01 mol��L-1NaOH��Һ�����ֲ������( )
NH4+ +OH-�������м�������0.01 mol��L-1NaOH��Һ�����ֲ������( )| A��c(NH4+) | B��c(OH-) | C��c(NH3��H2O) | D��c(NH4+)��c(OH-) |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com