
| 简单实验方案 | 预测的实验现象 | 结论 |
| 假设 | ||
| 假设 |
 ,故答案为:
,故答案为: ;
;| 简单实验方案 | 预测的实验现象 | 结论 |
| 向褪色后的溶液中再加入过量NaOH溶液 | 溶液又变红色 | ① |
| 溶液颜色无变化(依然为无色) | ② |


科目:高中化学 来源: 题型:
| A、金属与非金属交界处 |
| B、过渡元素区域(副族和第Ⅷ族) |
| C、长周期金属元素区域 |
| D、长周期非金属元素区域 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| B、核外电子排布相同的微粒化学性质也相同 | ||||
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
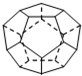 (1)德国和美国科学家首先制出由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成 (如图所示).请回答:C20分子共有
(1)德国和美国科学家首先制出由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成 (如图所示).请回答:C20分子共有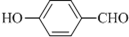 的沸点比
的沸点比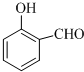 高,其原因是
高,其原因是查看答案和解析>>
科目:高中化学 来源: 题型:
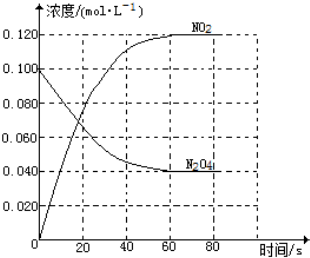 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com