
| A. | 稀硫酸中:K+、MnO4-、CH3CH2OH | |
| B. | pH=10的溶液中:Na+、SO32-、NH3•H2O | |
| C. | 中性溶液中:Na+、NO3-、AlO2- | |
| D. | FeCl3溶液中:H2O2、Mg2+、SO42- |
分析 A.酸性条件下,高锰酸根离子具有强氧化性,可以氧化乙醇;
B.碱性条件下,各微粒之间不反应,可以大量共存;
C.偏铝酸根水解,溶液呈酸性;
D.铁离子可以催化过氧化氢分解.
解答 解:A.酸性条件下,高锰酸根离子具有强氧化性,可以氧化乙醇乙酸,不能大量共存,故A错误;
B.碱性条件下,各微粒之间不反应,可以大量共存,故B正确;
C.偏铝酸根水解,溶液呈酸性,中性溶液中不可能含有大量的偏铝酸根离子,故C错误;
D.铁离子可以催化过氧化氢分解,不能大量共存,故D错误.
故选:B.
点评 本题考查离子共存问题,关键是理解掌握物质的性质,注意掌握离子反应发生的条件及共存问题中隐含条件,如溶液颜色、酸碱性、以及水电离氢离子浓度、能与Al反应生成氢气等.


科目:高中化学 来源: 题型:选择题
| A. | 实验室可用浓硫酸干燥SO2气体 | |
| B. | 准确量取25.00 mL的液体可选用量筒或滴定管等量具 | |
| C. | 无色气体燃烧后生成的气体通入Ba(OH)2溶液,有白色沉淀生成,则原气体一定是CO | |
| D. | FeCl3、CuCl2的混合液中加铁粉充分反应后仍有固体存在,再加KSCN溶液可呈现血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、NH4+、SO42-、CO32- | |
| B. | 与铝反应产生大量氢气的溶液中:Ca2+、Fe2+、Cl-、NO3- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-6的溶液中:K+、Na+、I-,SO42- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液中:Na+、K+、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
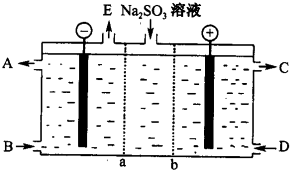
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1molMgCl2 | B. | 3molKClO3 | C. | 1molAlCl3 | D. | 1.5molCaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
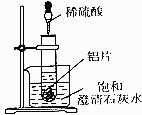 如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.
如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
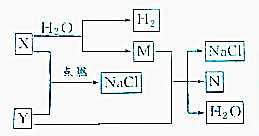 已知下列转化关系:
已知下列转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2~3次 | |
| B. | 应该选择酚酞作指示剂 | |
| C. | 滴定过程中眼睛应始终注视滴定管内液面变化 | |
| D. | 读取标准液的刻度时,滴定前平视,滴定后仰视,测定结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com