
[选修—化学与技术]
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有 、 。
(2)天然水在净化处理过程中加入的混凝剂可以是 其纯净水作用的原理是
(3)水的纯净和软化的区别是
(4)硬度为![]() 的水是指每升水含10
的水是指每升水含10![]() 或与之相当的物质(如7.1
或与之相当的物质(如7.1![]() )。若某天然水中
)。若某天然水中![]() ,
,![]() ,则此水的硬度为 ;
,则此水的硬度为 ;
(5)若(4)中的天然水还含有![]() ,现要软化10
,现要软化10![]() 这种天然水,则需先加入
这种天然水,则需先加入![]()
![]() ,后加入
,后加入![]()
![]() 。
。
(1)O2 CO2(或氮气)
(2)明矾、硫酸铝、硫酸铁、硫酸亚铁
铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的
(3)水的净化是用混凝剂(如明矾等)将水中胶体及悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子
(4)10°
(5)740 1484
本题主要考查天然水的净化和软化等知识,要求能根据题中信息计算天然水的硬度,以及通过计算确定软化时化学试剂的加入量。天然水的净化是利用含Al3+、Fe3+和Fe2+等盐的混凝剂水解生成的Al(OH)3或Fe(OH)3胶体吸附水中悬浮物,最终使其聚沉,达到净水的目的。水的软化是指利用化学方法除去水中Ca2+和Mg2+的过程。(4)水的硬度是由Ca2+和Mg2+共同产生的,即硬度为1.2×10-3×56×103/10+6×10-4×40×103/7.1=10°。(5)根据题中数据可以算出10m3这种天然水中含Ca2+为1.2×10-3×10×103=12mol,同理可求出含有Mg2+和HCO3-分别为6mol和8mol。软化硬水时,加入Ca(OH)2发生的反应为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O,Mg2++2OH-=Mg(OH)2↓。两步反应共消耗10mol Ca(OH)2,其质量为740g。此时被沉淀的Ca2+为4mol,水中剩余Ca2+为原天然水中剩余的8mol和加入Ca(OH)2中的6mol,故还需加入14molNa2CO3使其沉淀完全,其质量为1484 g。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:阅读理解
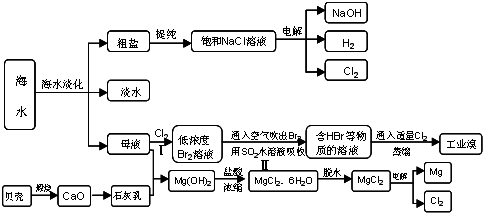
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

 (1)写出设备A、B的名称:A
(1)写出设备A、B的名称:A查看答案和解析>>
科目:高中化学 来源: 题型:
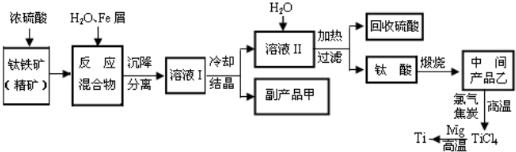
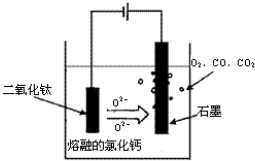
查看答案和解析>>
科目:高中化学 来源: 题型:
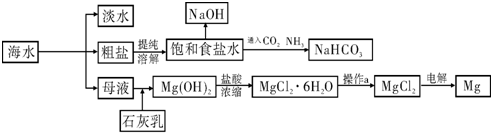
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com