
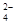 等离子,电极为惰性电极。下列叙述中正确的是
等离子,电极为惰性电极。下列叙述中正确的是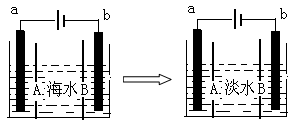
| A.A膜是阳离子交换膜 |
| B.通电后,海水中阴离子往b电极处运动 |
| C.通电后,b电极上产生无色气体,溶液中出现白色沉淀 |
| D.通电后,a电极的电极反应式为:4OH--4e- = O2↑+2H2O |
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
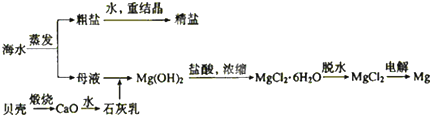
科目:高中化学 来源:不详 题型:实验题
| | 开始沉淀的pH | 完全沉淀的pH |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |

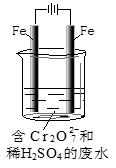
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2SO4 | B.AgNO3 | C.Na2SO4 | D.NaOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 KIO3 + 3H2↑。下列有关说法正确的是
KIO3 + 3H2↑。下列有关说法正确的是| A.电解时,石墨作阴极,不锈钢作阳极 |
| B.电解时,阳极反应是:I –-6e–+ 3H2O = IO3 – + 6H+ |
| C.在KI溶液溶液中加入酚酞,电解时阳极区变红色 |
| D.电解时溶液中I –向阴极迁移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
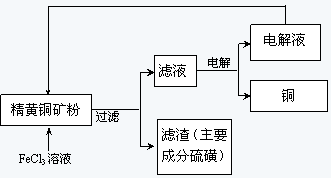
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.阳极反应式为C + 2O2- - 4e-=CO2↑ |
| B.由TiO2制得1mol 金属Ti ,理论上外电路转移4 mol电子 |
| C.制备金属钛前后,装置中CaO的量不变 |
| D.TiO2在阴极放电 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
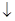 ,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是
,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是
A.图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2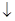 |
| B.图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去 |
| C.图乙电解池中,若有0.084 g阳极材料参与反应,则阴极会有336 mL的气体产生 |
| D.若图甲燃料电池消耗3.6 g镁产生的电量用以图乙废水处理,理论上可产生10.7 g氢氧化铁沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2 | B.Ag | C.Cl2 | D.O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com