
【题目】CO2回收与利用是环境科学家研究的热点课题。利用CO2制备合成气(CO、H2),再制备高值产品,如甲醇等,也可以利用CO2直接制备甲醇等产品。
(1)已知几种反应的正反应活化能(E1)、逆反应活化能(E2)如表所示:
序号 | 化学反应 | E1/(kJ·mol-1) | E2/(kJ·mol-1) |
① | 2CO(g)+O2(g)===2CO2(g) | 1954 | 2519 |
② | H2(g)+ | 685 | 970 |
③ | 2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) | 3526 | 4978 |
在相同条件下,起始反应最快的是____(填序号)。由H2和CO合成气态甲醇的热化学方程式为________。
(2)T1℃下,在2L恒容密闭容器中充入0.20mol CO和0.60mol H2合成CH3OH,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,经5min恰好达到平衡,CH3OH的浓度是0.05mol·L-1。
CH3OH(g) △H<0,经5min恰好达到平衡,CH3OH的浓度是0.05mol·L-1。
①T1℃时,以H2表示的反应的平均速率为___,平衡常数K=____。
②(T1+100)℃时,在1L恒容密闭容器中充入0.10molCO、0.20molH2和0.30mol CH3OH,此时反应将____(填“向左移动”“向右移动”“达到平衡”或“无法判断”)。
(3)CO2和H2在催化剂作用下反应,可以直接合成甲醇:CO(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,测得相同时间内甲醇产率与温度的关系如图所示。
CH3OH(g)+H2O(g) △H<0,测得相同时间内甲醇产率与温度的关系如图所示。
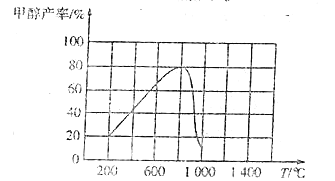
①温度在800℃时甲醇产率最高的主要原因是/span>____。
②下列措施能提高CO2平衡转化率的是____(填字母)。
A.升温 B.加压 C.加入催化剂 D.增大H2浓度
(4)利用电解法在酸性条件下将CO2和H2O转化或CO和H2,阴极反应式之一为CO2+2e-+2H+=CO+H2O,其机理如下:①CO2+2e-+H2O===CO+2OH-(慢反应);②OH-+CO2=HCO3-(快反应);③HCO3-+H+=CO2+H2O(快反应)。其中水的作用是___;控制阴板反应速率的反应是___(填序号)。
【答案】② CO(g)+2H2(g)===CH3OH(g) △H=-126.5kJ·mol-1 0.02mol·L-1·min-1 25 向左移动 200~800℃间,温度升高速率增大,800~1000℃间催化剂活性(或选择性)降低,速率减慢,升高温度平衡逆向移动, 甲醇产率降低,所以温度在800℃时甲醇产率最高 BD 催化作用 ①
【解析】
(1)正反应活化能小,活化分子百分数越大;反应热等于正、逆反应活化能之差,先求出反应①、②、③的反应热,再由盖斯定律计算H2和CO合成气态甲醇的反应热;
(2)利用“三段式”计算速率和平衡常数;根据Q、K的关系判断反应方向;
(3)根据影响速率和平衡移动的因素分析;
(4)慢反应决定总反应的速率。
(1)正反应活化能小,活化分子百分数越大,开始反应速率越大,所以在相同条件下,起始反应最快的是②。反应热等于正、逆反应活化能之差,①2CO(g)+O2(g)===2CO2(g)△H=-565kJ·mol-1 、②H2(g)+![]() O2(g)=H2O(l) △H=-285kJ·mol-1、③2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) △H=-1452kJ·mol-1;由盖斯定律知,①×
O2(g)=H2O(l) △H=-285kJ·mol-1、③2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) △H=-1452kJ·mol-1;由盖斯定律知,①×![]() +②×2-③×
+②×2-③×![]() 得CO(g)+2H2(g)===CH3OH(g) △H=-126.5kJ·mol-1;
得CO(g)+2H2(g)===CH3OH(g) △H=-126.5kJ·mol-1;
(2)CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始 0.1 0.3 0
转化 0.05 0.1 0.05
平衡 0.05 0.2 0.05
①v(H2)= ![]() ,
, ![]() 。
。
②正反应放热,在(T1+100)℃时平衡常数K<25,![]() ,反应向左进行。
,反应向左进行。
(3)①200~800℃间,升温,反应速率增大,产率升高;800~1000℃,升温,催化剂活性或选择性降低,产率降低,升高温度平衡逆向移动, 甲醇产率降低。
②从平衡移动角度,升高温度,平衡逆向移动,升温二氧化碳转化率降低;增大压强和增大氢气浓度都能使平衡向右移动,提高CO2的转化率;加入催化剂平衡不移动,二氧化碳转化率不变,故选BD。
(4)观察三步反应知,水参与第①步反应,第③步反应生成水,水起催化作用。第①步反应较慢,控制阴极反应反应速率的是①。


 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质。设计了如下图所示装置进行实验.
已知:1.0 mol/L的Fe(NO3)3溶液的pH=1。

请回答:
(1)装置A中用于添加浓硫酸的仪器名称为__________________。
(2)实验前鼓入N2的目的是________________________________。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是_________________。
②按观点2,装置B中反应的离子方程式是______________________________,
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号)_____。
A.1 mol/L稀硝酸 |
B.1.5 mol/L Fe(NO3)2溶液 |
C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:

(1)酮洛芬中含氧官能团的名称为______________和______________。
(2)由B→C的反应类型是____________________。
(3)写出D→E反应的化学方程式______________________________________________。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式_____________________。
Ⅰ.能发生银镜反应
Ⅱ.水解产物之一遇FeCl3溶液显色
Ⅲ.分子中含有4种不同化学环境的氢原子
(5)请写出以甲苯和乙醇为原料制备化合物![]() 的合成路线流程图(无机试剂可任选)________________。
的合成路线流程图(无机试剂可任选)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用电化学法还原CO2是一种使CO2资源化的方法。下图是利用此法制备ZnC2O4的示意图(电解液不参与反应)。下列说法中正确的是

A. Zn与电源的负极相连
B. ZnC2O4在交换膜右侧生成
C. 电解的总反应为2CO2+Zn![]() ZnC2O4
ZnC2O4
D. 通入11.2 L CO2时,转移0.5 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被誉为第三金属,广泛用于航天航空等领域。硼化钒(VB2)-空气电池的放电反应为4VB2+11O2===4B2O3+2V2O5,以该电池为电源制备钛的装置如图所示。
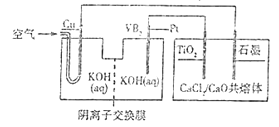
下列说法正确的是( )
A. 电解过程中,OH-由阴离子交换膜右侧向左侧迁移
B. Pt极反应式为2VB2+22OH--22e-===V2O5+2B2O3+11H2O
C. 电解过程中,铜极附近电解质溶液的pH减小
D. 若石墨极只收集到4.48LCl2气体,则理论上制备4.8gTi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯达莫司汀是一种抗癌药物。其中一种合成苯达莫司汀中间体H的路线如图:

已知:RCH== CHR’![]() RCOOH+R’COOH
RCOOH+R’COOH
(1)C的命名是____,H中含氧官能团是___(填名称)。
(2)E的结构简式是______,C到D的反应类型是______。
(3)写出B→C的化学方程式:______。
(4)M是 的同分异构体,M能发生银镜反应,和NaHCO3反应产生气体,M可能有___种,若分子中只有3种不同化学环境的氢,则符合条件的M的结构简式是_____。
的同分异构体,M能发生银镜反应,和NaHCO3反应产生气体,M可能有___种,若分子中只有3种不同化学环境的氢,则符合条件的M的结构简式是_____。
(5)请写出以![]() 和适当的无机试剂为原料制备
和适当的无机试剂为原料制备![]() 的合成路线流程图:_____。
的合成路线流程图:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组从商店买回的浓硫酸试剂标签的部分内容破损。由于试剂瓶口密封签已破损,他们怀疑该硫酸的质量分数与标签不符,决定开展研究。部分破损标签内容为硫酸:化学纯(CP) 品名:硫酸, 化学式:H2SO4相对分子质量:98,质量分数:98% 密度:1.84g/cm3。甲同学认为,可以用一种精密仪器测量该溶液的c(H+),若c(H+)=36.8 mol·L-1,则该溶液的质量分数为98%。乙同学认为,即使有精密的仪器,甲同学的方案也不行,建议用重量分析法来测定。具体设想:取一定体积的该硫酸与足量氯化钡溶液反应,过滤、洗涤、干燥沉淀,称量沉淀的质量。丙同学则建议用中和滴定法进行测定,设想如下:①准确量取一定体积的硫酸,用适量的水稀释;②往稀释后的溶液中滴入几滴指示剂;③用碱式滴定管量取标准浓度的氢氧化钠溶液滴定,直到出现滴定终点为止;④记录消耗的氢氧化钠溶液的体积。
请回答下列问题:
(1)乙同学推测甲同学的方案不可行的理由是_____________________________________
(2)乙同学的方案的关键操作有两点:①确保SO42-完全沉淀;②洗涤沉淀,确保沉淀不含杂质。在实际中,请设计简单实验检验SO42-是否完全沉淀:____________________________
检验沉淀是否洗净的操作方法是__________________________________________________;
(3)在丙同学的方案中步骤②用到的指示剂是____________;达到滴定终点的标志是______________________________________________________________________________。
(4)丙同学的方案中,下列操作使测定结果偏小的是_____________。
①在滴定前未用NaOH标准溶液润洗滴定管,②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分仍有气泡,③锥形瓶用蒸馏水洗净后,没有用待测液润洗,④滴定前,仰视读数,滴定后,仍仰视读数,⑤滴定前,仰视读数,滴定后,俯视读数
(5)丙同学在实验中,分别取等体积原硫酸,用NaOH溶液滴定三次,终点时,得到的NaOH溶液体积如下表所示:
实验序号 | 硫酸体积 | NaOH溶液体积 | NaOH溶液浓度 |
① | 5.00 mL | 35.65 mL | 5.00 mol·L-1 |
② | 5.00 mL | 39.65 mL | 5.00 mol·L-1 |
③ | 5.00 mL | 35.55 mL | 5.00mol·L-1 |
通过计算,该浓硫酸物质的量浓度为____________________________________________。是否与标签上表示的溶质质量分数相同___________(填“是”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:2A(g)+3B(g) ![]() 3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
(1)该反应在30℃时平衡常数K1=_________ ,焓变△H_______0(填“>”、“<”或“=”)。
(2)从反应开始到达到化学平衡状态v(A)____________mol/(L·min)
(3)该反应在70℃时平衡常数为K2,则 K1_______K2(填“>”、“=”或“<”)
(4)可以判断2A(g)+3B(g) ![]() 3C(g) 反应已经达到平衡(____)
3C(g) 反应已经达到平衡(____)
A.2v(B)=3v(A)
B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D.混合气体的平均相对分子质量不再改变
E.n(A)∶n(B)∶n(C)=2∶3∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
D. ①与③溶液中,水的电离程度:①>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com