
(8��)
(1)6.20g ����(P4)��������������ȫȼ������������,��Ӧ�����ĵ������ڱ�״���µ����Ϊ________________L.����ȼ������������������ˮ���50.0mLH3PO4��Һ,����Һ�����ʵ���Ũ��Ϊ____________ mol ��L-1
(2)��0.300molH3PO4��Һ�μӵ���0.500mol Ca(OH)2������Һ��,��Ӧǡ����ȫ,����1�������κ�16.2 g ˮ,�������εĻ�ѧʽ�ɱ�ʾΪ____________��
 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��09�㶫����.���֣� �������ˮ�ⷴӦ����ʽΪ��
HCOOCH3(l)+H2O(l)![]() HCOOH(l)+CH3OH(l)����H>0
HCOOH(l)+CH3OH(l)����H>0
ijС��ͨ�������о��÷�Ӧ����Ӧ����������仯���Բ��ƣ�����Ӧ��ϵ�и���ֵ���ʼ�����±���
| ��� | HCOOCH3 | H2O | HCOOH | CH3OH |
| ���ʵ���/mol | 1.00 | 1.99 | 0.01 | 0.52 |
�������ת�������¶�T1���淴Ӧʱ�䣨t���ı仯����ͼ��

��1�������������������㲻ͬʱ�䷶Χ�ڼ��������ƽ����Ӧ���ʣ�������±���
| ��Ӧʱ�䷶Χ/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| ƽ����Ӧ����/(10��3mol��min��1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
�����15-20min��Χ�ڼ�������ļ�����Ϊ mol�����������ƽ����Ӧ����Ϊ mol��min-1(��Ҫ��д���������)��
��2�������������ݣ�д���÷�Ӧ�ķ�Ӧ�����ڲ�ͬ�εı仯���ɼ���ԭ�� ��
��3��������Ӧ��ƽ�ⳣ������ʽΪ��![]() ����÷�Ӧ���¶�T1�µ�KֵΪ ��
����÷�Ӧ���¶�T1�µ�KֵΪ ��
��4�������������䣬���ı��¶�ΪT2��T2����T1�����ڴ����ͼ�л����¶�T2�¼������ת�����淴Ӧʱ��仯��Ԥ�ڽ��ʾ��ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�����������У���ꡱ��һ��ѧ����ĩ���Ի�ѧ�� ���ͣ������
(8��)��1��3.01��1022��OH-�����ʵ���Ϊ ����Ϊ ����ЩOH-�� mol NH3��������ȣ��� g Na+���е���������ͬ��
�ƽ�4.6 g �������ڿ����г��ȼ�յõ�����ɫ��ĩ���÷�ĩ��ˮ��Ӧ�ܹ��ų���״
�������ڿ����г��ȼ�յõ�����ɫ��ĩ���÷�ĩ��ˮ��Ӧ�ܹ��ų���״
���µ����� L��ʵ���������Һ��Na+�����ʵ���Ϊ ��
��ͬ��ͬѹͬ����İ�����NH3�������⣨H2S����������ʵ���֮��Ϊ ԭ�Ӹ���֮�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014������ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
��8�֣�����ݹ����ŵIJ�ͬ�������л�����з��ࡣ�����������ո�(��8��)
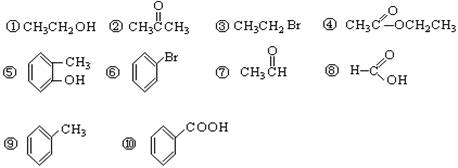
��1���������� ����2��±������ ����3������
��4���ӣ� ����5��ȩ�� ����6��ͪ��
��7����� ����8������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012������ʡ�߶���ѧ������������ѧ�Ծ������ƣ� ���ͣ������
��14�֣�
��i����ϵͳ������������������(��6��)
�� ��
��  ��
��
��ii������ݹ����ŵIJ�ͬ�������л�����з��ࡣ�����������ո�(��8��)

��1���������� ����2��±������ ����3������
��4���ӣ� ����5��ȩ�� ����6��ͪ��
��7����� ����8������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�����������У���ꡱ��һ��ѧ����ĩ���Ի�ѧ�� ���ͣ������
(8��)��1��3.01��1022��OH-�����ʵ���Ϊ ����Ϊ ����ЩOH-�� mol NH3��������ȣ��� g Na+���е���������ͬ��
�ƽ�4.6 g�������ڿ����г��ȼ�յõ�����ɫ��ĩ���÷�ĩ��ˮ��Ӧ�ܹ��ų���״
���µ����� L��ʵ���������Һ��Na+�����ʵ���Ϊ ��
��ͬ��ͬѹͬ����İ�����NH3�������⣨H2S����������ʵ���֮��Ϊ ԭ�Ӹ���֮�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com