
【题目】水是生命之源,它与我们的生活密切相关。自来水厂常用高铁酸钠(Na2FeO4)改善水质。高铁酸钠具有很强的氧化性,是一种新型的绿色净水消毒剂,在工业上制备高铁酸钠的方法有多种。
(1)简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理_________________________________________________________________________。
(2)干法制备高铁酸钠的反应原理如下:
2FeSO4+6Na2O2==aNa2FeO4+bM↑+2Na2O+2Na2SO4
①高铁酸钠中铁元素的化合价为________________。
②上述方程式中b=____。每生成1molM,该反应转移电子的物质的量为_____________mol。
(3)工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
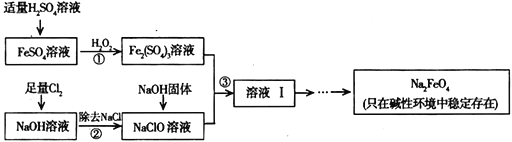
①步骤③中除生成Na2FeO4外,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为____________________________________。
②己知Na2FeO4在强碱性溶液中的溶解度较小。可向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液。从Na2FeO4悬浊液得到固体的操作名称为_____________________。
(4)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_______倍(结果保留两位小数。)
【答案】 高铁酸钠具有很强的氧化性,能杀菌消毒,本身被还原为Fe3+、Fe2+水解生成氢氧化铁胶体能吸附水中的杂质,起到净水作用 +6 1 10 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O 过滤 0.64
【解析】(1)高铁酸钠具有强氧化性,可用于杀菌消毒,还原生成Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,可用来除去水中的悬浮物,达到净水的目的,故答案为:FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的;
(2)①钠元素显+1价,氧元素显-2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6价,故答案为:+6;
②2FeSO4+6Na2O2==aNa2FeO4+bM↑+2Na2O+2Na2SO4,根据质量守恒,a=2,M为O2,b=1,方程式配平得2FeSO4+6Na2O2═2Na2FeO4+O2↑+2Na2O+2Na2SO4,反应中铁元素化合价升高(6-2)×2=8,过氧化钠中的氧元素化合价升高(1-0)×2=2,化合价降低(2-1)×10=10,即每生成1mol O2,转移电子10mol,故答案为:1;10;
(3)①步骤③是碱溶液中次氯酸根离子氧化铁离子为高铁酸根离子,反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
②从Na2FeO4悬浊液得到固体可以通过过滤实现,故答案为:过滤;
(4)FeO42-+3e-+4H2OFe(OH)3+5OH-,单位质量得到电子![]() =0.018;Cl2+2e-=2Cl-,单位质量得到电子
=0.018;Cl2+2e-=2Cl-,单位质量得到电子![]() =0.028,
=0.028, ![]() =0.64,故答案为:0.64。
=0.64,故答案为:0.64。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】大量燃煤产生烟气会造成空气中二氧化硫含量增多,某研究小组利用燃煤电厂的固体废弃物粉煤灰(主要含Al2O3、SiO2等)进行烟气脱硫研究,并制备Al2(SO4)3·18H2O。
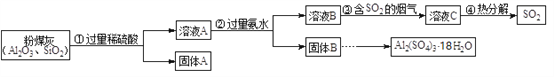
(1)上述①②③④步实验操作中,需要过滤的是______。
(2)第②步不能用氢氧化钠溶液的原因是______(用化学方程式表示)。
(3)下列关于步骤③、④的说法正确的是______。
a.溶液C可用于制备氮肥
b.溶液B中的硫酸铵将烟气中的SO2除去
c.热分解获得的SO2可以回收再利用
(4)从固体B制备Al2(SO4)3·18H2O的实验操作是:加入稀硫酸、加热浓缩、______、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是______;电解质溶液Y是________。
(2)银电极为电池的______极,发生的电极反应式为_______________;X电极上发生的电极反应式为_________________。
(3)下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。则电极a为电解池的_______极,b电极附近出现的现象为______________。
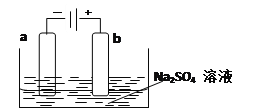
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于烷烃性质的叙述,错误的是
A. 烷烃不能使酸性高锰酸钾溶液褪色
B. 烷烃都能燃烧
C. 烷烃在水中的溶解度随着碳原子数的增加而增大
D. 烷烃都能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间的反应不能通过一步反应实现的是( )
A.Na2CO3→NaClB.NaCl→ NaOH
C.NaOH→NaClD.CuO→Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关丙烯(CH3CH=CH2)的结构或性质叙述中不正确的是
A. 分子中所有碳原子都在同一平面上
B. 能使溴水褪色
C. 能使酸性高锰酸钾溶液褪色
D. 与氯化氢发生加成反应只能生成一种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(ρ=1.84 g/cm3)配制1 mol/L稀硫酸100 mL。
(1)实验操作:
a.用100mL量筒量取98%的浓硫酸___________mL;
b.选取对应规格的容量瓶,洗涤,检查是否漏液,将稀释并冷却至室温的硫酸溶液沿玻璃棒转移到此容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中;
d.在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌;
e.向容量瓶中直接加蒸馏水至离刻度线1~2 cm处;
f.盖上容量瓶瓶塞,摇匀;
g.用胶头滴管小心加蒸馏水至刻度线;
h.将配制好的溶液转移入含少量蒸馏水的试剂瓶中贮存备用。
(2)实验
①正确的操作步骤是__________________________________________________(填序号)。
②此实验中玻璃棒的作用是__________________________________________________。
③实验操作中有两处错误,这两处错误是:________________________、_________________________。
(3)下列操作对所配溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
①量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中______________。
②定容时俯视容量瓶刻度线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列反应的化学方程式,用双线桥法标明电子转移的方向和数目,并注明“被氧化”、“被还原”。
①Fe2O3与CO在高温下的反应:___________________________________。
②KClO3与MnO2在共热条件下反应:________________________________。
③H2S气体和SO2气体反应生成S和水:______________________________。
(2)写出下列反应的离子方程式,并用单线桥法标明电子转移的方向和数目。
①Cu和AgNO3溶液反应:________________________________________。
②实验室制Cl2的反应为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O:___________________________。
MnCl2+Cl2↑+2H2O:___________________________。
③向FeCl2溶液中通入Cl2生成FeCl3:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com