
【题目】在三个密闭容器中分别充入Ne、H2、O2三种气体,在以下各种情况下排序正确的是( )
A. 当它们的体积、温度和压强均相同时,三种气体的密度![]()
B. 当它们的温度和密度都相同时,三种气体的压强![]()
C. 当它们的质量、温度和压强均相同时,三种气体的体积![]()
D. 当它们的压强、体积和温度均相同时,三种气体的质量![]()
【答案】B
【解析】Ne、H2、O2的相对分子质量依次为20、2、32,相对分子质量:O2![]() Ne
Ne![]() H2。A项,当它们的体积、温度和压强均相同时,气体的密度之比等于相对分子质量之比,则三种气体的密度ρ(O2)
H2。A项,当它们的体积、温度和压强均相同时,气体的密度之比等于相对分子质量之比,则三种气体的密度ρ(O2)![]() ρ(Ne)
ρ(Ne)![]() ρ(H2),错误;B项,当它们的温度和密度都相同时,气体的压强与相对分子质量成反比,则三种气体的压强P(H2)
ρ(H2),错误;B项,当它们的温度和密度都相同时,气体的压强与相对分子质量成反比,则三种气体的压强P(H2)![]() P(Ne)
P(Ne)![]() P(O2),正确;C项,当温度和压强均相同时,气体的体积的体积之比等于物质的量之比,质量相同时三种气体物质的量由大到小的顺序为n(H2)
P(O2),正确;C项,当温度和压强均相同时,气体的体积的体积之比等于物质的量之比,质量相同时三种气体物质的量由大到小的顺序为n(H2)![]() n(Ne)
n(Ne)![]() n(O2),三种气体的体积V(H2)
n(O2),三种气体的体积V(H2)![]() V(Ne)
V(Ne)![]() V(O2),错误;D项,当它们的压强、体积和温度均相同时,三种气体物质的量相等,质量之比等于相对分子质量之比,三种气体的质量m(O2)
V(O2),错误;D项,当它们的压强、体积和温度均相同时,三种气体物质的量相等,质量之比等于相对分子质量之比,三种气体的质量m(O2)![]() m(Ne)
m(Ne)![]() m(H2),错误;答案选B。
m(H2),错误;答案选B。


科目:高中化学 来源: 题型:
【题目】化合物X是一种用于合成γ分泌调节剂的药物中间体,其结构简式如右图所示。下列有关化合物X的说法正确的是( )
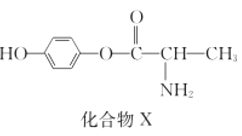
A. 化合物X分子中没有手性碳原子
B. 化合物X能与FeCl3溶液发生显色反应
C. 1 mol化合物X最多能与2 mol NaOH反应
D. 化合物X能发生水解反应,一定条件下可水解得到一种α氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )

A. 海水淡化的方法主要有蒸馏法、电渗析法、冰冻法
B. 氯碱工业中采用阴离子交换膜可提高产品的纯度
C. 由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铅( PbO)是黄色固体。实验室用草酸在浓硫酸作用下分解制备CO,其原理为:H2C2O4![]() CO↑+CO2↑+H2O。某课题组同学设计实验探究CO 还原氧化铅并检验氧化产物(已知CO能使银氨溶液产生黑色沉锭)的装置如图所示。下列说法正确的是
CO↑+CO2↑+H2O。某课题组同学设计实验探究CO 还原氧化铅并检验氧化产物(已知CO能使银氨溶液产生黑色沉锭)的装置如图所示。下列说法正确的是
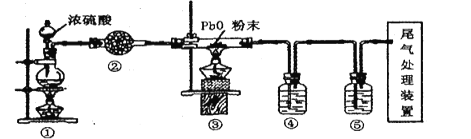
A. 装置②④⑤中的试剂依次为碱石灰、银氨溶液、澄清石灰水
B. 实验时,先点燃装置①处酒精灯,当装置⑤中产生连续气泡且有明显现象后再点燃装置③处酒精灯
C. 实验完毕时,先熄灭装置①处酒精灯,再熄灭装置③处酒精灯
D. 尾气处理可选用点燃、气袋收集、NaOH 溶液吸收等方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)元素⑩名称为____在周期表中的位置_____。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是____,碱性最强的化合物的电子式是:_____。
(3)用电子式表示素④与⑥的化合物的形成过程:_____,该化合物属于____(填“共价”或“离子”)化合物。
(4)写出一种由上述元素组成的既有离子键又有非极性共价键的物质的化学式_____。
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是_______(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.1 mol二氧化碳中含有1 mol碳和2 mol氧
B.0.012 kg12C中含有的碳原子数约为6.02×1023
C.1 mol甲烷的质量为16 g·mol-1
D.2 g氢气所含的原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气。某研究性学习小组模拟生产企业制取氢化钙。
(实验)
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2。
(1)下列有关该实验的说法正确的是_____________________________________。
a.其他条件相同时,粗锌制取氢气的速率比纯锌快
b.加热时,必须通入氮气作为保护气,以防止空气的干扰
c.可以用浓硫酸或碱石灰对H2进行干燥除杂
d.开始实验时,应先通入H2,后给金属钙加热
e.停止实验时,应先停止通入H2,后停止加热
(提出假设)
(2)由于实验中操作不当,金属钙或氢化钙都可能被氧化;该小组甲同学对反应后的固体产物成分提出如下假设:
假设1:含有Ca和CaH2;
假设2:含有CaH2和CaO;
假设3:含有__________________。
(设计实验方案,验证假设)
(3)定性实验用化学方法鉴别Ca与CaH2,请设计实验完成下表中内容。
实验步骤 | 预期现象和结论 |
取少量固体样品,____________________________________________________________________。 | _______________________________________________。 |
(4)定量实验测定Ca和CaH2混合物中CaH2的质量分数。
①取m1 g样品与水完全反应,利用如图装置测定生成的气体体积时,在________时进行收集(填字母)。
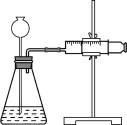
a.刚开始有气泡
b.气泡连续均匀
c.气体经过验纯后,再收集
②如果装置气密性良好,操作正确,乙同学认为:由于液体加入,导致气体的体积测定_____________(填“偏高”“偏低”或“无影响”),则计算出氢化钙的质量分数_____________(填“偏高”“偏低”或“无影响”)。
(反思与交流)
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便。既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是_______________________________________________________________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为______。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为_______。
(3)与CN-互为等电子体的一种分子为______(填化学式);1mol Fe(CN)63-中含有σ键的数目为______。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于_______(填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为_______。
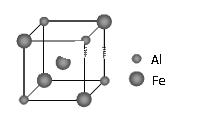
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com