
下列有关对定量实验误差分析正确的是
A.现需90ml1.0mol/LNaOH溶液 ,称取3.6gNaOH固体配制——溶液浓度偏低
B.测定溶液 pH的实验中,用润湿的pH试纸测定新制氯水的pH——测定结果偏高
C.中和热实验测定中,缓慢地将NaOH溶液倒入测定装置中——对测定结果无影响
D.酸碱中和滴定实验中,标准液滴定前无气泡而滴定后有气泡——测定结果偏高
科目:高中化学 来源:2014-2015内蒙古北方重工业集团三中高二下学期第一次月考化学试卷(解析版) 题型:选择题
乙醇分子中各种化学键如图所示。关于乙醇在下列反应中断键情况的说法中不正确的是

A.与金属钠反应时键①断裂
B.与乙酸发生酯化反应时键①断裂
C.与浓硫酸共热到170 ℃时键③、④断裂
D.在铜催化下与氧气反应时键①、③断裂
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省高一3月月考化学试卷(解析版) 题型:填空题
(12分)某溶液可能含有K+、Mg2+、Al3+、Cl2、SO42-、S2-、NO3-中的几种,为确定溶液中的微粒种类,进行如下实验:
①通过观察,发现溶液呈浅黄绿色;
②取少许原溶液,滴加NaOH溶液直至过量,发现先有沉淀生成,后沉淀减少但并不完全消失;
③取少许原溶液,滴加BaCl2溶液,无白色沉淀生成。
请根据上述信息回答下列问题:
(1)原溶液中肯定存在上述微粒中的________________,肯定不存在的微粒有_______________。
(2)不能确定是否存在上述微粒中的______________________,确定其是否存在的实验方法是____________________(不要求写具体操作过程)。
(3)若步骤②中得到沉淀的最大质量为9.7g,最终剩余沉淀质量为5.8g,据此步骤可确定原溶液中一定存在的微粒的物质的量之比为____________________。
(4)下列离子还可以在原溶液中大量共存的是___________(填字母)。
A.OH- B.Fe2+ C.NH4+ D.CO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:填空题
(10分)金属镁是六方最密堆积,金属铜是面心立方最密堆积,下图分别给出它们的堆积状况和晶胞示意图,它们空间利用率相同,假定镁、铜原子均为刚性小球,已知球的半径分别为R1厘米、R2厘米,阿伏伽德罗常数NA
| (1)镁原子在二维空间的配位数为 |
(2)位于晶胞中部的鎂原子与离它最近两平面 (填“相离”或“相切”或”相交”) | |
(3)请用含R1、NA的数学式子表达金属镁的密度: g/cm3(根号带在分子上) | |
| (4)铜原子在三维空间的配位数为 |
(5)晶胞中面心上的六个铜原子构成的空间几何体名称为 | |
(6)请用含R2、NA的数学式子表达金属铜的密度: g/cm3(根号带在分子上) |
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:选择题
一定温度下,向300 mL l mol/L的NaOH溶液中通入bmol CO2,下列说法正确的是
A.通入CO2过程中溶液中的Kw减小
B.b=0.3与b=0.15时,所得溶液中的微粒种类不相同
C.当b=0.2时,所得溶液中部分离子浓度关系为:c(HCO3一)>c(CO32-)>c(OH-)>c(H+)
D.当恰好生成NaHCO3时,溶液中存在:c(Na+ )+c(H十)=c(HCO3-)+c(OH一)
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:选择题
下列关于杂化轨道的叙述中,不正确的是
A.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
B.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
C.杂化前后的轨道数不变,但轨道的形状发生了改变
D.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省梅州市高三高三总复习质检理综化学试卷(解析版) 题型:推断题
(16分)已知:乙酸酐﹝(CH3CO)2O)﹞常用作有机合成原料。
反应①
反应②
(1)结晶玫瑰是具有强烈玫瑰香气的香料,其分子式为_____________。1mol肉桂酸最多能与_______mol H2发生加成反应。
(2)上述反应①、②中的产物Ⅰ能与碳酸氢钠反应并放出气体,则Ⅰ的结构简式是___________
(3)溴苯与丙烯酸乙酯(CH2=CHCOOC2H5)在氯化钯催化下可直接合成肉桂酸乙酯,反应的化学方程式为________________________________________________(不要求标出反应条件)
(4)结晶玫瑰也可以由下列反应路线合成(部分反应条件略去):

反应③的反应类型是_______________。反应⑤的反应条件为__________________________。
Ⅱ的同分异构体Ⅲ遇FeCl3溶液显色,Ⅲ与足量饱和溴水混合未见白色沉淀产生,Ⅲ与NaOH的乙醇溶液共热发生消去反应,则Ⅲ的结构简式为__________________________(只写一种)

据此推断经反应④得到一种副产物,其核磁共振氢谱有________种峰。(2分)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:选择题
CH4和N2在一定条件下能直接生成氨:3CH4(g)+2N2(g)  3C(s)+4NH3(g)
3C(s)+4NH3(g) 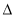 H>0,700 ℃时,
H>0,700 ℃时,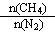 与CH4的平衡转化率的关系如图所示。下列判断正确的是
与CH4的平衡转化率的关系如图所示。下列判断正确的是
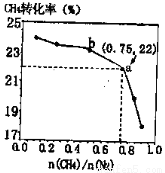
A.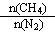 越大,CH4的转化率越高
越大,CH4的转化率越高
B.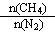 不变时,升温,NH3的体积分数会减小
不变时,升温,NH3的体积分数会减小
C.b点对应的平衡常数比a点的大
D.a点对应的NH3的体积分数约为13%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市延庆县高三3月模拟理综化学试卷(解析版) 题型:实验题
(12分)硫酸铜、硝酸铁都是重要的化工原料。
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4·5H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
①红褐色滤渣的主要成分是__________;
②写出浸出过程中生成硝酸铜的化学方程式 ;
③操作I的温度应该控制在________左右;
④从溶液中分离出硫酸铜晶体的操作II应为将热溶液_______、______、洗涤、干燥。
(2)某兴趣小组在实验室利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行Fe(NO3)3对H2O2分解速率影响的实验。5min后可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是___________________ 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com