
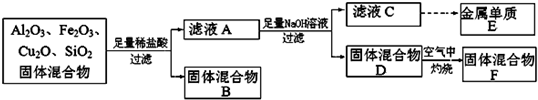
(9分)22. 某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
(1)混合物中是否存在FeCl2:____________(填“是”或“否”)。
(2)混合物中是否存在(NH4)2SO4:____________(填“是”或“否”)。
(3)写出反应⑤的离子方程式:________________________。
(4)请根据图中数据分析,原固体混合物的成分为 (写化学式)
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
Ⅰ | 7.4 | 40.00 | 1.68 |
Ⅱ | 14.8 | 40.00 | 3.36 |
Ⅲ | 22.2 | 40.00 | 1.12 |
Ⅳ | 37.0 | 40.00 | 0.00 |
(1)实验过程中有关反应的离子方程式为__________________。
(2)由Ⅰ组数据直接推测:标准状况下3.7 g样品进行同样实验时,生成氨气的体积为________L。
(3)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比。
(4)欲计算该NaOH溶液的物质的量浓度应选择第________组数据,由此求得NaOH溶液的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以回收高浓度的SO2并得到副产品化肥(NH4)2SO4和NH4HSO4。为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[已知:(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0 |
(1)测定过程中有关反应的离子方程式为
_____________________________ 。
(2)3.7g该样品进行同样实验时,生成的氨气在标准状况下体积为__________L。
(3)试求算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比。
(4)欲计算该NaOH溶液的物质的量浓度应选择第______组数据,并由此计算NaOH溶液的物质的量浓度,写出计算过程。
查看答案和解析>>
科目:高中化学 来源:上海市嘉定、黄浦区2010届高三第二次模拟考试化学试题 题型:计算题
为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以回收高浓度的SO2并得到副产品化肥(NH4)2SO4和NH4HSO4。为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[已知:(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
|
实验序号 |
样品的质量/g |
NaOH溶液的体积/mL |
氨气的体积/L |
|
Ⅰ |
7.4 |
40.00 |
1.68 |
|
Ⅱ |
14.8 |
40.00 |
3.36 |
|
Ⅲ |
22.2 |
40.00 |
1.12 |
|
Ⅳ |
37.0 |
40.00 |
0 |
(1)测定过程中有关反应的离子方程式为
_____________________________ 。
(2)3.7g该样品进行同样实验时,生成的氨气在标准状况下体积为__________L。
(3)试求算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比。
(4)欲计算该NaOH溶液的物质的量浓度应选择第______组数据,并由此计算NaOH溶液的物质的量浓度,写出计算过程。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com