
| A. | 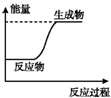 | B. | 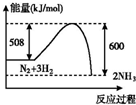 | C. | 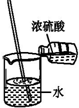 | D. |  |
分析 A.图中中反应物能量低于生成物,为吸热反应;
B.氮气和氢气能量总和大于氨气能量,反应为放热反应;
C.浓硫酸溶于水溶液温度升高;
D.稀盐酸和锌发生氧化还原反应,反应过程中放热.
解答 解:A.图象分析可知,反应物能量小于生成物,反应为吸热反应,故A正确;
B.图象表示的氮气和氢气能量总和大于生成的氨气能量,反应为放热反应,故B错误;
C.浓硫酸慢慢到入水中溶解稀释,过程中放出热量,故C错误;
D.稀盐酸滴入盛锌粒的试管中发生置换反应,反应属于氧化还原反应,过程中放出热量,故D错误;
故选A.
点评 本题考查了化学反应能量变化、浓硫酸稀释等,注意反应前后能量守恒的分析应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
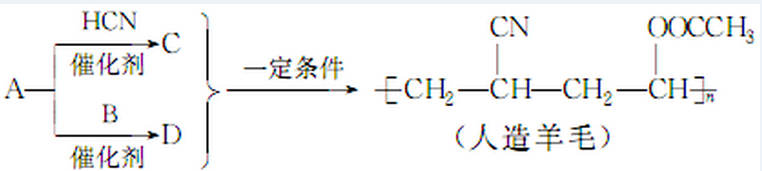
| A. | 合成人造羊毛的反应属于缩聚反应 | B. | A生成C的为反应属于加成反应 | ||
| C. | A生成D的反应属于取代反应 | D. | 烃A的结构简式为CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
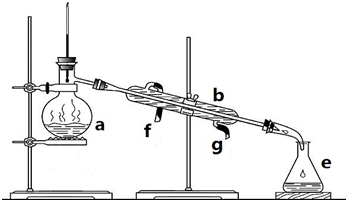
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2与稀NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | Fe2(SO4)3和KI溶液反应:Fe3++2I-═Fe2++I2 | |
| C. | 烧碱溶液中加入铝片:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
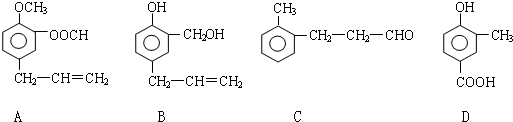
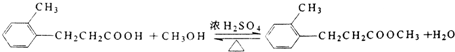 .
.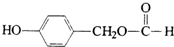 ;H:
;H: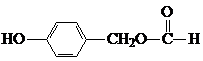 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
.| 试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
| 质量 分数 | 体积/mL | |||||
| Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
| Ⅱ | 温度对反应速率的影响 | 5.0 | 60℃ | 0 | 0 | |
| Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | 0 | |
| Ⅳ | 4.0% | 5.0 | 常温 | 0 | 1.0 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com