
��֪��Ӧ��CO(g)+H2O(g)�� ![]() �� H2(g)+CO2(g)�� ��H=��41.2kJ/mol�����ɵ�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ���Ƶ�CH4��
�� H2(g)+CO2(g)�� ��H=��41.2kJ/mol�����ɵ�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ���Ƶ�CH4��

(1)850��ʱ��һ���Ϊ10 L�ĺ����ܱ������У�ͨ��һ������CO��H2O(g)��CO��H2O(g)Ũ�ȱ仯����ͼ��ʾ������˵����ȷ������������ (�����)��
A���ﵽƽ��ʱ����Ӧ��ϵ���ջ�ų�49.44kJ������
B����4minʱ����������ƽ����Է����������ٱ仯�����ж��Ѵﵽƽ�⣻
��C����6minʱ���������¶ȣ���Ӧƽ�ⳣ������������ 850��ʱ����Ũ�ȵı仯
D����8minʱ��������CO���ᵼ��v(��)��v(��)��ƽ��������Ӧ�����ƶ���
(2)850��ʱ�������ݻ�Ϊ2L���ܱ�������ͬʱ����1.0 mol CO��3.0 mol H2O��1.0 mol CO2��x mol H2����Ҫʹ������Ӧ��ʼʱ������Ӧ������У���xӦ����������������������� ��
(3)�罫H2��CO2��4��1������Ȼ�ϣ����ʵ��������¿��Ƶ�CH4����֪��
���� CH4(g) + 2O2(g)=CO2 (g)+ 2H2O (1)���� ��H1����890.3 kJ/mol
���� H2(g)+![]() O2(g)=H2O���������� (1)���� ��H2����285.8 kJ/mol
O2(g)=H2O���������� (1)���� ��H2����285.8 kJ/mol
��CO2(g)��H2(g)��Ӧ����CH4(g)��Һ̬ˮ���Ȼ�ѧ����ʽ�������������� ����������������
(4)������ȼ�ϵ����������̼����Ϊ����ʣ���CH4Ϊȼ�ϣ�����Ϊ��������ϡ����������Ϊ�缫��������ӦʽΪ������������������ ��������ӦʽΪ������������������������ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��8�֣���֪��Ӧ��CO(g) + H2O(g)H2(g) + CO2(g) ��H= Q kJ��mol-1����ƽ�ⳣ�����¶ȵı仯���±���
| �¶�/�� | 400 | 500 | 850 |
| ƽ�ⳣ�� | 9.94 | 9 | 1 |
��ش��������⣺
��1���������淴Ӧ��Q 0������ڡ���С�ڡ�����
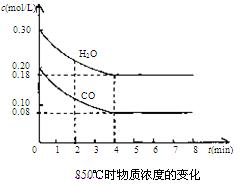
��2��850��ʱ�����Ϊ10L��Ӧ���У�ͨ��һ������CO��H2O��g������������Ӧ��CO��H2O(g)Ũ�ȱ仯����ͼ���Իش�
��0��4 min��ƽ����Ӧ����v(CO)=______ mol/(L��min)
�����б�������Ϊ�ÿ��淴Ӧ�ﵽƽ���־����__________(�����)��
A�������������ܶȱ��ֲ���ʱ
B������Ӧ����0.1molCO(g)ͬʱҲ����0.1molH2O(g)ʱ
C����CO(g)�������������ֲ���ʱ
D�����÷�Ӧ�Ħ�H����ʱ
��3����Ҫ�ӿ�÷�Ӧ���ʣ�ͬʱ��Ҫ���CO��ת���ʣ��ɲ�ȡ�Ĵ�ʩΪ_____(�����)��
A������ˮ�������� B�������¶�
C��ʹ�ô��� D������ѹǿ E����������CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011�캣��ʡ�����и����߿����в��Եػ�ѧ�Ծ� ���ͣ������
��8�֣���֪��Ӧ��CO(g) + H2O(g) H2(g) + CO2(g) ��H=" Q" kJ��mol-1����ƽ�ⳣ�����¶ȵı仯���±���
H2(g) + CO2(g) ��H=" Q" kJ��mol-1����ƽ�ⳣ�����¶ȵı仯���±���
| �¶�/�� | 400 | 500 | 850 |
| ƽ�ⳣ�� | 9.9 4 4 | 9 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��߿���ѧ����ר���̵�6�� ��ѧ��Ӧ���ʺͻ�ѧƽ����ϰ���������棩 ���ͣ�ѡ����
��֪��Ӧ����CO(g)��CuO(s)??CO2(g)��Cu(s)�ͷ�Ӧ����H2(g)��CuO(s)  Cu(s)��H2O(g)����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�Ӧ����CO(g)��H2O(g)
Cu(s)��H2O(g)����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�Ӧ����CO(g)��H2O(g)  CO2(g)��H2(g)��ƽ�ⳣ��ΪK��������˵����ȷ����(����)
CO2(g)��H2(g)��ƽ�ⳣ��ΪK��������˵����ȷ����(����)
A����Ӧ����ƽ�ⳣ��K1��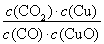
B����Ӧ����ƽ�ⳣ��K��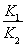
C�����ڷ�Ӧ��������ʱ���¶����ߣ�H2Ũ�ȼ�С����÷�Ӧ���ʱ�Ϊ��ֵ
D�����ڷ�Ӧ�������º����£�����ѹǿ��H2Ũ��һ����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ����и߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�������
��֪��Ӧ��CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
��427��Cʱ��ƽ�ⳣ����9��4�������Ӧ��ʼʱ��һ����̼��ˮ������Ũ�ȶ���0��01mol��L-1������һ����̼�ڴ˷�Ӧ�����µ�ת���ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�꺣��ʡ�����и����߿����в��Եػ�ѧ�Ծ� ���ͣ������
��8�֣���֪��Ӧ��CO(g) + H2O(g) H2(g) + CO2(g) ��H= Q kJ��mol-1����ƽ�ⳣ�����¶ȵı仯���±���
|
�¶�/�� |
400 |
500 |
850 |
|
ƽ�ⳣ�� |
9.94 |
9 |
1 |
��ش��������⣺
��1���������淴Ӧ��Q 0������ڡ���С�ڡ�����
��2��850��ʱ�����Ϊ10L��Ӧ���У�ͨ��һ������CO��H2O��g������������Ӧ��CO��H2O(g)Ũ�ȱ仯����ͼ���Իش�
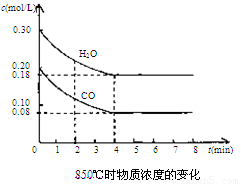
��0��4 min��ƽ����Ӧ����v(CO)=______ mol/(L��min)
�����б�������Ϊ�ÿ��淴Ӧ�ﵽƽ���־����__________(�����)��
A�������������ܶȱ��ֲ���ʱ
B������Ӧ����0.1molCO(g) ͬʱҲ����0.1molH2O(g)ʱ
C����CO(g)�������������ֲ���ʱ
D�����÷�Ӧ�Ħ�H����ʱ
��3����Ҫ�ӿ�÷�Ӧ���ʣ�ͬʱ��Ҫ���CO��ת���ʣ��ɲ�ȡ�Ĵ�ʩΪ_____(�����)��
A������ˮ�������� B�������¶�
C��ʹ�ô��� D������ѹǿ E����������CO2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com