
【题目】以芳香烃A(苯环上只有一个侧链)为原料发生如图所示的变化,可以合成高聚物G。

已知:①两个羟基连在同一碳原子上不稳定,会自动脱水。如: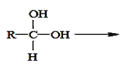 R—CHO
R—CHO
②C能发生银镜反应,F能使溴水褪色。
回答下列问题:
(1)A中官能团的名称是___;C的结构简式为___。
(2)B→C的反应条件是___,E→F的反应类型是___。
(3)写出E→G的化学方程式___。
(4)E的同分异构体中,苯环上有3个取代基、遇FeCl3溶液显紫色且能与碳酸氢钠溶液反应的共有___种(不考虑立体异构)。
(5)参照上述合成路线,设计以丙炔为原料制备乳酸(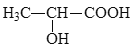 )的合成路线___(无机试剂任选)。
)的合成路线___(无机试剂任选)。
【答案】碳碳三键 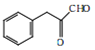 NaOH的水溶液,加热 消去 n
NaOH的水溶液,加热 消去 n
![]()
 +(n-1)H2O 20 CH3C≡CH
+(n-1)H2O 20 CH3C≡CH![]() CH3CBr2CHBr2
CH3CBr2CHBr2![]() CH3COCHO
CH3COCHO![]() CH3COCOOH
CH3COCOOH![]()
![]()
【解析】
![]()
![]()
![]() A的不饱和度
A的不饱和度![]() ,苯环的不饱和度是4,因为支链上只有3个碳原子,则说明该分子中还含有1个碳碳三键,A和溴水发生加成反应生成B,B发生水解反应生成C,两个羟基连在同一碳原子上不稳定,会自动脱水,结合C的分子式知,C结构简式为
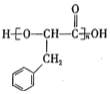
,苯环的不饱和度是4,因为支链上只有3个碳原子,则说明该分子中还含有1个碳碳三键,A和溴水发生加成反应生成B,B发生水解反应生成C,两个羟基连在同一碳原子上不稳定,会自动脱水,结合C的分子式知,C结构简式为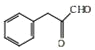 ,B为
,B为![]() ,A为
,A为![]() ;根据E分子式知,C发生氧化反应生成D,D为
;根据E分子式知,C发生氧化反应生成D,D为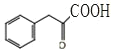 ,D发生还原反应生成E,E为
,D发生还原反应生成E,E为![]() ,E发生缩聚反应生成G,G为
,E发生缩聚反应生成G,G为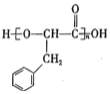 ,E发生消去反应生成F为
,E发生消去反应生成F为![]() 。
。
(1)由分析可知,A为![]() ,A中官能团的名称是碳碳三键;C的结构简式为
,A中官能团的名称是碳碳三键;C的结构简式为 ;
;
(2)B发生水解反应生成C,B→C的反应条件是NaOH的水溶液,加热,E为![]() ,F为
,F为![]() ,E→F的是消去反应;
,E→F的是消去反应;
(3)E→G的化学方程式:n![]()
![]()
 +(n-1)H2O;
+(n-1)H2O;
(4)E为![]() ,E的同分异构体,苯环上有3个取代基、遇FeCl3溶液显紫色且能与碳酸氢钠溶液反应,则三取代基可分两种情况:三取代基为:酚羟基、羧基、乙基;酚羟基、甲基、
,E的同分异构体,苯环上有3个取代基、遇FeCl3溶液显紫色且能与碳酸氢钠溶液反应,则三取代基可分两种情况:三取代基为:酚羟基、羧基、乙基;酚羟基、甲基、![]() ;每种取代方式均有10种同分异构体,故符合条件的E的同分异构体共有20种;
;每种取代方式均有10种同分异构体,故符合条件的E的同分异构体共有20种;
(5)参照题干合成路线,可设计以丙炔为原料制备乳酸(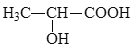 )的合成路线:CH3C≡CH
)的合成路线:CH3C≡CH![]() CH3CBr2CHBr2
CH3CBr2CHBr2![]() CH3COCHO
CH3COCHO![]() CH3COCOOH
CH3COCOOH![]()
![]() 。
。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】对硝基甲苯(![]() )是医药、染料等工业的一种重要有机中间体,一种制备对硝基甲苯的实验步骤如下:
)是医药、染料等工业的一种重要有机中间体,一种制备对硝基甲苯的实验步骤如下:
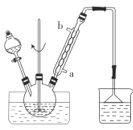
步骤1:向三颈烧瓶中加入甲苯(液态),以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),以CCl4为溶剂,乙酸酐为脱水剂(与水反应生成乙酸),45℃下搅拌、回流1h。实验装置如图所示(加热和仪器固定装置均已略去)。
步骤2反应结束后,过滤,滤液分别用5%NaHCO3溶液、水洗至中性。
步骤3:所得液体再经分离提纯得到对硝基甲苯。
(1)装置中,冷却水应从______________(填“a”或“b”)口通入。
(2)反应须控制在45℃下进行的原因是______________。
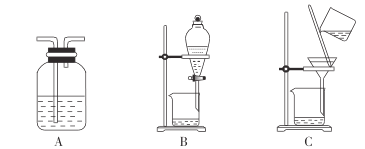
(3)步骤2中,过滤所得滤渣是______________(填化学式);对滤液进行洗涤可用下列装置中的______________(填字母)。
(4)表中所给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
NaHSO4 | 0.15 | 44.6 | 55.l | 0.3 | 98.9 |
0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
已知:对硝基甲苯、邻硝基甲苯和间硝基甲苯的沸点分别为238.5℃、222℃和230.5℃。
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______________,
②与浓硫酸作催化剂相比,NaHSO4作催化剂的优点有______________、______________。
③步骤3中,从三种异构体的混合物中分离出对硝基甲苯的方法为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为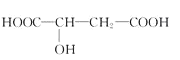 苹果酸可能发生的反应是( )
苹果酸可能发生的反应是( )
①与NaOH溶液反应;②与石蕊试液作用变红;③与金属钠反应放出气体;
④一定条件下与乙酸酯化;⑤一定条件下与乙醇酯化:
A.①②③B.①②③④C.①②③⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)物质的量相同,下列物质充分燃烧与A充分燃烧消耗氧气的量不相等的是(填序号)_______。
A. C7H12O2 B.C6H14 C.C6H14O D. C7H14O3
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种,则A的结构简式为_____________。
(3)若链烃A的分子结构中有三种氢原子,个数比为3:2:1,则A的名称为________。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B、C、D有如下转化关系。回答下列问题:
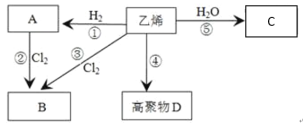
(1)乙烯的电子式为_______,分子中含有的共价键类型有_______(填极性键或非极性键)。
(2)写出下列反应的化学方程式和有机反应类型:
反应④_______,反应类型:________;反应⑤________,反应类型:________。
(3)反应②和反应③都可以用来制备物质B,反应②的条件为_________。
(4)某单烯烃通过加成反应得到的某烷烃的相对分子质量为86,则该烯烃的分子式为____,该烷烃存在多种同分异构体,请写出只能由一种烯烃加成得到的烷烃的结构简式:_______,并用系统命名法命名:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成氧化铜,氧化铜再与硝酸反应。下列叙述正确的是( )
A.三种途径所消耗的铜的物质的量不相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗铜的物质的量是:途径③>途径①>途径②
D.所消耗硝酸的物质的量是:途径①>途径②>途径③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
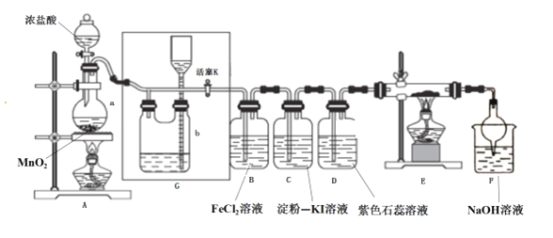
(1)A中发生反应的化学反应方程式为________________________________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置D中能看到的实验现象分别是 ___________________ ;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为______________________________;
③装置F中球形干燥管的作用是____________________________;
(3)储气瓶b内盛放的试剂是______________________________;
(4)B处发生反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究碳酸钙与稀盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况(0~t1、t1~t2 、t2~t3各时间段相同),绘制出如图所示的曲线。下列说法不正确的是

A.反应速率最大的是0~t1段,生成气体最多的是t3~t4段
B.t1~t2段曲线变化的可能是盐酸与大理石反应放热导致的
C.t2~t3时间段里影响反应速率的主要外界因素是浓度
D.为了减缓反应速率可向盐酸中加入NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过一硫酸氢钾复合盐(KHSO4·2KHSO5·K2SO4)常用作漂白剂和消毒剂,其制备流程如图:
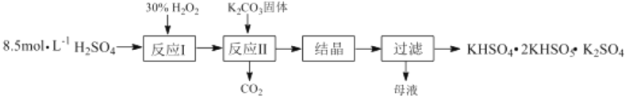
(1)反应Ⅰ的化学方程式为:H2O2+H2SO4H2SO5+H2O,△H<0;则反应Ⅱ中K2CO3与H2SO5反应生成KHSO5的化学方程式为___。
(2)生产原料的理论比值[n(H2O2):n(H2SO4)]为0.4:1,但实际生产最佳投料比为0.6:1,其原因是___。
(3)准确称取3.350g复合盐样品配制成250mL溶液,取25.00mL置于锥形瓶中,加入适量的稀硫酸和足量的KI溶液,摇匀后置于暗处,充分反应后,加入少量淀粉溶液,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消粍标准溶液20.00mL。计算复合盐中有效成分KHSO5的质量分数。(写出计算过程)(已知:HSO5-+I-+H+→SO42-+I2+H2O,I2+S2O32-→I-+S4O62--未配平)___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com