
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 实验编号 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| 1 | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | A | B | D |
| 3 | 350 | C | 5 |
分析 (1)①依据平衡常数随温度变化分析,温度越高平衡常数越小,说明平衡逆向进行;
②依据浓度商和平衡常数比较分析判断反应进行的方向;
③该同学通过“控制变量法”探究外界条件对化学平衡的影响,探究的前提只能是改变一个条件,而其它条件不变,据此解答;
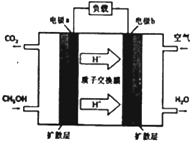
(2)①原电池中负极上燃料失电子,酸性条件下,CH3OH反应生成二氧化碳;
②根据总反应进行计算.
解答 解:(1)①由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,根据反应自发进行的判据:△H-T△S<0.得到此反应较低温度下有利于该反应自发进行;
故答案为:<;较低;
②将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时的浓度商Qc=$\frac{2}{2×{3}^{2}}$=$\frac{1}{9}$,小于0.27,故反应向正反应进行,故选:A;
③通过“控制变量法”探究外界条件对化学平衡的影响,探究的前提只能是改变一个条件,而其它条件不变,由此可得:Ⅱ中温度A为150℃,n (CO)/n(H2)B为$\frac{1}{3}$,D为5,Ⅲ中n (CO)/n(H2)C为$\frac{1}{3}$;
故答案为:150℃;5;
(2)①原电池放电时,甲醇失电子被氧化,a应为电池负极反应,b是负极,正极是氧气得电子的还原反应O2+4H++4e-=2H2O,负极上是燃料甲醇失电子的氧化反应,即H2O+CH3OH-6e-=CO2+6H+,
故答案为:正;H2O+CH3OH-6e-=CO2+6H+;
②燃料电池的总反应:2CH3OH+3O2=2CO2+4H2O,当电池消耗22.4L级1molO2(标况下)时,消耗甲醇质量是$\frac{2}{3}$mol×32g/mol=$\frac{64}{3}$g,故答案为:$\frac{64}{3}$g.
点评 本题综合性较大,涉及化学平衡常数、反应的热效应、原电池与电解池工作原理及计算等,难度中等,注意原电池书写.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属冶炼和处理常涉及氧化还原反应.
金属冶炼和处理常涉及氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2与浓HCl作用:MnO2+4HCl(浓)$\stackrel{△}{→}$MnCl2+Cl2↑+2H2O | |
| B. | KMnO4+16HCl(浓)→2KCl+2MnCl2↑+5Cl2↑+8H2O | |
| C. | KClO3+6HCl(浓)→KCl+3Cl2↑+3H2O | |
| D. | Ca(ClO)2+4HCl(浓)→CaCl2+2Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;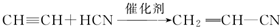 ;
;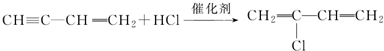 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 解释 | |
| A | 100℃0.1mol/L Na2SO4溶液pH=6.2 | H2O=H++OH- |
| B | 0.1mol/L CH3COOH的pH=3 | CH3COOH?CH3COO-+H+ |
| C | 配制FeCl3溶液时加少量盐酸 | Fe3++3H2O?Fe(OH)3+3H+ |
| D | 随温度有升高,碳酸钠溶液pH增大 | CO32-+2H2O?H2CO3+2OH- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
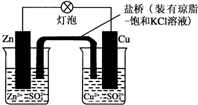
| A. | 负极反应为:Zn-2e-═Zn2+ | B. | 电池反应为:Zn+Cu2+═Zn2++Cu | ||
| C. | 在外电路中,电子从负极流向正极 | D. | 盐桥中的K+移向ZnSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com