
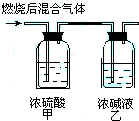
 燃烧法是测定有机化合物化学式的一种重要方法.现在完全燃烧0.1mol某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重10.8g,乙装置增重22g.求该烃的化学式.
燃烧法是测定有机化合物化学式的一种重要方法.现在完全燃烧0.1mol某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重10.8g,乙装置增重22g.求该烃的化学式. 分析 根据浓硫酸具有吸水性,增重10.8g,为水的质量,可求得烃中H原子个数,生成物通入碱溶液,增重的质量为二氧化碳的质量,可求得烃中C原子个数,以此可求得烃的分子式.
解答 解:浓硫酸具有吸水性,增重10.8g,为水的质量,则n(H2O)=$\frac{10.8g}{18g/mol}$=0.6mol,
n(H)=2n(H2O)=2×0.6mol=1.2mol,即0.1mol烃中含有1.2molH原子,所以该烃分子中H原子个数为12,
生成物通入NaOH溶液,增重的11.2g质量为二氧化碳的质量,
则n(CO2)=$\frac{22g}{44g/mol}$=0.5mol,n(C)=n(CO2)=0.5mol,
即0.1mol烃中含有0.5molC原子,所以该烃分子中C原子个数为5,
所以该烃的分子式为C5H12.
答:该烃的化学式C5H12.
点评 本题考查学生燃烧法确定有机物分子组成,侧重于学生的分析、计算能力的考查,根据原子守恒法来解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L氯气所含有的原子数目为NA | |
| B. | 9 g水所含有的氢原子数目为NA | |
| C. | 在同温同压时,相同物质的量的任何气体的体积相同且为11.2L | |
| D. | 0.1 mol甲烷分子含有的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酸钠(NaNO2)俗称工业盐,外观和食盐相似,有咸味,易溶于水,水溶液显碱性,加强热时能分解产生有刺激性气味的气体,人若误食会引起中毒,致死量为0.3g~0.5g,它使人中毒是因为它能将人体血红蛋白中的Fe2+转化为Fe3+,从而使血红蛋白丧失携氧能力.
亚硝酸钠(NaNO2)俗称工业盐,外观和食盐相似,有咸味,易溶于水,水溶液显碱性,加强热时能分解产生有刺激性气味的气体,人若误食会引起中毒,致死量为0.3g~0.5g,它使人中毒是因为它能将人体血红蛋白中的Fe2+转化为Fe3+,从而使血红蛋白丧失携氧能力.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径为D>C>A>B | B. | 原子序数为a>b>c>d | ||
| C. | 离子半径为aA->bB2->cC+>dD2+ | D. | a+2=c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2作呼吸面具中的供氧剂 | |
| B. | 硫磺用于制火药 | |
| C. | 镁合金用于制造汽车、飞机、火箭 | |
| D. | BaCO3作“钡餐”--检查肠胃的内服药 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
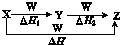 X、Y、Z、W有如下所示的转化关系,且△H=△H1+△H2,则X、Y可能是( )
X、Y、Z、W有如下所示的转化关系,且△H=△H1+△H2,则X、Y可能是( )| A. | ①②③④⑤ | B. | ②④⑤ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com