
【题目】指出下列分子中带*号的原子采用的杂化方式:
(1)HO2________
(2)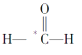 _________
_________
(3)*CO2________
(4)CHCH2OH_______
科目:高中化学 来源: 题型:
【题目】实验室经常用KMnO4与过量浓盐酸反应制备氯气,化学方程式如下:2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O。
(1)用单线桥标出电子转移的方向和数目:__________。
(2)将此反应改写为离子方程式:___________________。
(3)若31.6g KMnO4与过量浓盐酸充分反应,被氧化的HCl的物质的量为_____,在标准状况下生成的Cl 2的体积为____。
(4)用生成的氯气通入下面的装置来验证氯气的某些性质。
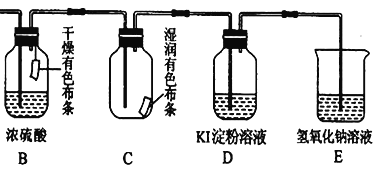
用离子方程式解释C中有色布条褪色的原因:______________,将B、C的顺序颠倒,可否达到原来的实验目的:______(填“可以”或“不可以”);D是用来检验氯气性质的实验,可观察到溶液由无色变为蓝色(I2单质遇淀粉变蓝色),请比较Cl2、I2 、KMnO4 的氧化性,由强到弱为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯化硫(S2Cl2)是一种重要的有机合成氯化剂,实验室和工业上都可以用纯净干燥的氯气与二硫化碳反应来制取(CS2+3Cl2![]() CCl4+S2Cl2),其装置如下:
CCl4+S2Cl2),其装置如下:
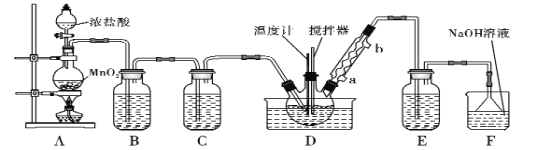
(1)A装置中的离子反应方程式为______________。
(2) 一氯化硫(S2Cl2)常温下较为稳定,受热易分解,易被氧化,且遇水即歧化,歧化产物中不仅有淡黄色固体,而且还有两种气体,用NaOH溶液吸收该气体可得两种盐Na2SO3和NaCl。 写出一氯化硫与水反应的化学反应方程式______________。
(3)B装置的作用是___________________________________。
(4)D中冷凝管的冷水进水口为____(填“a”或“b”);实验过程中,需要先点燃A处酒精灯,通入氯气一段时间后方可向D中水槽里面加入热水加热,这样做的目的是______________。
(5)F装置是用来处理尾气氯气的,已知该吸收反应的氧化产物不仅有NaClO还有NaClO3,且n(NaClO)/n(NaClO3)=3/1,则该反应被还原的氯原子与被氧化的氯原子物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子晶体的数据大小比较不正确的是
A. 熔点:NaF>MgF2>AlF3B. 晶格能:NaF>NaCl>NaBr
C. 阴离子的配位数:CsCl>NaClD. 硬度:MgO>CaO>BaO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体立体构型示意图如下图所示。


(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:__________________________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是__________________________________________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为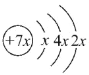 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)A为____(写出元素符号,下同);
(2)B为____,简化电子排布式是____;
(3)C为____,核外电子排布式是____;
(4)D为____,轨道表示式是____;
(5)E原子结构示意图是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH﹣=BaSO4↓+2H2O
C.向氢氧化钠溶液中通入足量CO2:2OH-+CO2=CO32-+H2O
D.向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用2.0 mol/L NaCl溶液配制100mL 0.10 mol/L NaCl溶液。
(1)计算:配制上述溶液,需要2.0 mol/L NaCl溶液_____________mL;
(2)称量:用量筒正确量取所需溶液;
(3)溶解:所需仪器是_____________、_____________;
(4)转移:将烧杯中的溶液沿着玻璃棒小心引流到___________________中;
(5)洗涤:将烧杯和玻璃棒洗涤2~3次并将洗涤液也都注入容量瓶中;
(6)定容:往容量瓶中加蒸馏水至距刻度线_________cm处,改用__________________加蒸馏水至液面与刻度线相切。盖好瓶塞摇匀;
(7)配制过程中出现以下情况,对所配溶液浓度有何影响(填偏高、偏低、不变):
①没有洗涤烧杯和玻璃棒_____________;
②量取2.0 mol/L NaCl溶液时俯视量筒的刻度线_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。
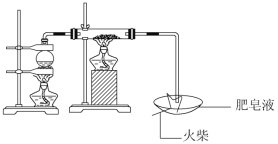
反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当肥皂泡爆破,并有爆鸣声时,说明“铁与水蒸气”能够进行反应,写出铁与水蒸气反应的化学方程式__________________________。
(2)为了研究(1)中一定时间内铁粉的消耗量,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积(已折算成标准状况)。
①收集并测量气体体积应选下图中的________装置。
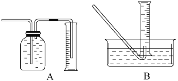
②称取0.24 g铁粉与适量石棉绒混合,然后加热至无气体放出。最好选用__________规格的量筒(选填字母序号)。
A.100 mL B.200 mL C.500 mL D.1 000 mL
(3)现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。
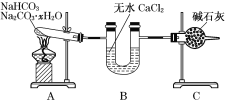
①若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89 g,C管增重0.22 g,则x的值为______。
②该装置还不是很完善,可能使测定结果偏小,应如何改进_____________________________。原因是___________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com