
 .下列有关说法正确的是( )
.下列有关说法正确的是( )| A. | 阿托酸的分子式为C9 H8O2 | |
| B. | lmol阿托酸最多能和4mol Br2发生加成反应 | |
| C. | 阿托酸分子中所有碳原子一定在同一平面 | |
| D. | 阿托酸能发生取代、加成、水解等反应 |
科目:高中化学 来源: 题型:填空题
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||

| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M:Na X:O2 | B. | M:IINO3 X:Fe | C. | M:NH3 X:O2 | D. | M:Al X:NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 五种短周期元素A、B、C、D、E原子序数依次增大,结合下列信息:
五种短周期元素A、B、C、D、E原子序数依次增大,结合下列信息: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
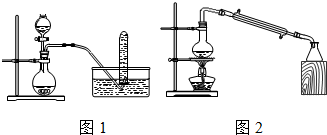
| A. | 铜与浓硝酸反应制取NO2可采用图1装置: | |
| B. | 图2实验装置设计正确,该装置可实现石油的分馏 | |
| C. | 分离乙酸和乙醇溶液:不能用分液漏斗进行分离 | |
| D. | 制乙酸乙酯时,把乙醇和乙酸依次加入浓硫酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m}{MV}$mol•L-1 | B. | $\frac{2m}{MV}$mol•L-1 | C. | $\frac{m}{2MV}$mol•L-1 | D. | $\frac{2M}{mV}$mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com