


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
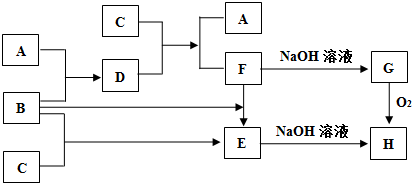
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾和FeCl3可作净水剂 |
| B、为保存FeCl3溶液,要在溶液中加少量盐酸 |
| C、用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 |
| D、氢氟酸用塑料试剂瓶保存而不用玻璃试剂瓶保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(Cl-)>c(OH-)>c(H+) |
| B、c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| C、c(Na+)=c(Cl-)>c(H+)>c(OH-) |
| D、c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液的pH大于盐酸 |
| B、醋酸溶液的pH小于盐酸 |
| C、与NaOH完全中和时,醋酸消耗的NaOH多于盐酸 |
| D、分别用水稀释相同倍数后,所得溶液中:n (Cl-)=n (CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、υ(H2O)=0.45 mol?L-1?s-1 |
| B、υ(O2)=0.010 mol?L-1?s-1 |
| C、υ(NO)=0.010 mol?L-1?s-1 |
| D、υ(NH3)=0.10 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有关信息 |
| X | X元素的原子最外层电子数是电子层数的3倍 |
| Y | Y元素所在主族序数与所在周期序数之差为4,Y是同周期中原子半径最小的元素 |
| Z | Z元素的单质在X元素的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
| M | M元素的最高价氧化物对应的水化物能与M元素的最简单气态氢化物反应生成盐R |
| N | N的化合物在灼烧时焰色呈黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com