
【题目】常温下,在10 mL 0.2 mol·L-1氨水中,滴入0.2 mol·L-1的稀盐酸,使溶液的pH=7。则下列说法正确的是( )
A.加入盐酸的体积大于10 mL B.c(NH![]() )=c(Cl-)
)=c(Cl-)
C.加入盐酸的体积等于10 mL D.c(NH![]() )<c(Cl-)
)<c(Cl-)
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】将10℃的0.2molN2O4置于2L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)![]() 2NO2(g)。下列结论能说明上述反应在该条件下已经达到平衡状态的是( )
2NO2(g)。下列结论能说明上述反应在该条件下已经达到平衡状态的是( )
①烧瓶内气体的平均相对分子质量不再变化
②NO2的物质的量浓度不再改变
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤烧瓶内气体的颜色不再加深
⑥N2O4的消耗速率与NO2的生成速率之比为1:2
⑦NO2生成速率与NO2消耗速率相等
⑧烧瓶内气体的密度不再变化。
A. ①②③⑤⑦ B. ①②③⑤⑥⑦ C. ①②③④ D. ②③⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应:A(s)+2B(g)![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.混合气体的平均分子量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种正盐的混合溶液中含有0.2molNa+、0.25molMg2+、0.4molCl-,则SO42-为
A.0.1mol B.0.3mol C.0.15mol D.0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.在共价化合物中不可能含有离子键
B.阴阳离子之间通过静电作用力形成的化学键,叫离子键
C.含有共价键的化合物一定是共价化合物
D.离子化合物中不一定含有金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述不正确的是
A. 明矾可以对自来水杀菌
B. 在医疗上碳酸氢钠可用于治疗胃酸过多
C. 人造刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3
D. 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016新课标Ⅰ卷】
(14分)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的_________,反应的化学方程式为_______________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)反应②是________________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。
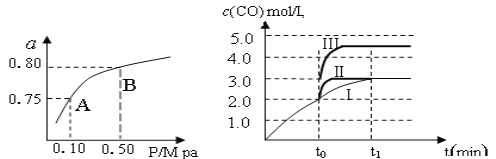
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如右上图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_____________________。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
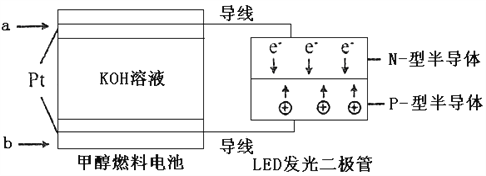
请写出加入(通入)b物质一极的电极反应式_________________;
每消耗6.4g甲醇转移的电子数为_______________。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某主族元素R的最高正化合价与最低负化合价的代数和为6,由此可以判断( )
A.R可能是第二周期元素
B.R一定是ⅥA族元素
C.R的气态氢化物比同周期其它元素气态氢化物稳定
D.R的气态氢化物化学式为H2R.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com