
| A��pH��ȵ�CH3COONa��NaOH��Na2CO3������Һ�� c(NaOH) < c(Na2CO3) < c(CH3COONa) |
| B��pH = 2��HA��Һ��pH = 12��MOH��Һ����Ȼ�ϣ� c(H��) + c(M��) = c(OH��) + c(A��) |
| C����pH=13��Na2S��Һ�У�Al3+��Cl����CH3COO�����ܴ������� |
| D����ˮ�������������Ũ��Ϊ10-1mol/L����Һ�У�SO32����NO3����Cl����Na�����ܴ������� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
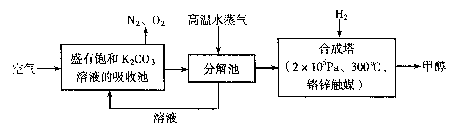
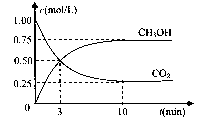
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ������ | K+ Ba2+ Ag+ Mg2+ NH4+ Na+ |
| ������ | SO42�� SO32�� CO32�� AlO2�� |
| �ų������� | �ų������� |
| | |
| �϶����ڵ����� | �ж����� |
| | |
| �ų������� | �ų������� |
| | |
| �д���������� | ���鷽�� |
| | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��HCO3����ClO����K+��H+ | B��Na+��Fe2+��NO3����H+ |
| C��K+��Cu2+��Cl����SO42�� | D��OH����NH4+��Cl����SO32�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

A������Һ��c(H+)Ϊ1��10-4 mol��L-1 | B������ҺlmLϡ����100mL��pH����6 | C�������Һ�м���������pHΪ10������������Һǡ����ȫ�к� | D������Һ�д���������c(H+)��ˮ�������c(H+)�ı�ֵΪ106 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Cl2��ˮ��Һ�ܵ��磬��Cl2���Ƿǵ���� |
| B��0.1mol/L�İ�ˮ����ʹ��̪��Һ��죬˵����ˮ��������� |
| C����pH=12��NaOH��Һͨ��һ��ʱ����Һ��pH>12 |
| D���к�pH���������ͬ������ʹ�����Һ������NaOH�����ʵ�����ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ʹPH=0����Һ�У� Fe2+��NO3-��SO42-��I- |
| B��C(H+)=10-14mol�� L-1����Һ�У�Na+��AlO2-��S2-��SO32- |
| C�����Ի����µ���ɫ����Һ�У�Na+��Cu2+��NO3-��SO42-�� |
| D������0.1 mol��L-1 Fe3+����Һ�У�K+��Mg2+��I-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��c��CH3COO�������ۣ��� |
| B��ˮ�������c��OH�������ڣ��� |
C���ٺ͢ڵ������Ϻ����Һ�� c��OH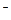 ����c��H+��+ c��CH3COOH�� ����c��H+��+ c��CH3COOH�� |
| D���ٺ͢۵������Ϻ����Һ�� c��Na+����c��CH3COO-����c��H+����c��OH-�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com