
| A. | 氢氧化镁与稀盐酸反应:H++OH-═H2O | |
| B. | 氯化钡溶液与硫酸钠溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | FeCl3溶液中加入Fe粉:Fe3++Fe═2Fe2+ | |
| D. | 碳酸钠溶液与足量醋酸反应:Na2CO3+2H+═2Na++CO2↑+H20 |
分析 A.氢氧化镁为难溶物质;
B.氯化钡溶液与硫酸钠溶液反应生成硫酸钡沉淀;
C.电荷不守恒;
D.醋酸为弱电解质,要写分子.
解答 解:A.氢氧化镁为难溶物质,则氢氧化镁与稀盐酸反应:2H++Mg(OH)2═Mg2++2H2O,故A错误;
B.氯化钡溶液与硫酸钠溶液反应生成硫酸钡沉淀,其反应的离子方程式为:Ba2++SO42-═BaSO4↓,故B正确;
C.FeCl3溶液中加入Fe粉:2Fe3++Fe═3Fe2+,故C错误;
D.碳酸钠溶液与足量醋酸反应:CO32-+2CH3COOH→2CH3COO-+CO2↑+H20,故D错误.
故选B.
点评 本题考查离子方程式的书写,侧重于学生的分析能力和元素化合物知识的综合运用的考查,注意把握离子的反应必须符合反应的实际,注意电荷守恒和质量守恒问题,难度不大.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:解答题
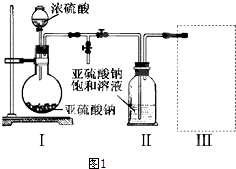
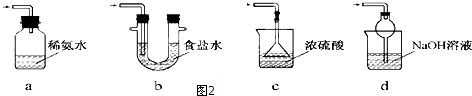

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 氧化性:Cl2>S | C. | 稳定性:HBr>HI | D. | 酸性:H3PO4>HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 荧光蛋白是一种高分子化合物且能发生水解 | |
| B. | 用纯碱溶液和盐酸可以清洗锅炉中的硫酸钙 | |
| C. | 利用次氯酸钠溶液的碱性对餐具和环境消毒 | |
| D. | 大量排放PM2.5、SO2、NOX等会形成雾霾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 氧化铁 | 碳酸钠 | 碳酸氢钠 |
| 俗名 | 铁红 | 小苏打 | |
| 化学式 | Na2CO3 | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
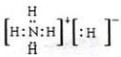 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA | |
| B. | 常温下,46 g分子式为C2H6O的物质中一定含有极性键为7NA,非极性键为NA | |
| C. | 125 mL 16 mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于NA | |
| D. | 标准状况下,体积为22.4 L NO2、N2O4的混合气体,升温至常温,则混合气体分子数为NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子.则该硫酸盐的物质的量浓度为
A.2 mol•L﹣1 B.7.5 mol•L﹣1 C.5 mol•L﹣1 D.2.5 mol•L﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com