
下列变化的实质相似的是
①浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
②二氧化硫和氧气均能使品红溶液褪色
③二氧化硫能使高锰酸钾溶液、溴水褪色
④氨气和碘化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸可用铁容器存放、加热条件下浓硫酸能与木炭反应
⑥浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
A.②③④ B.③⑤ C.③④⑥ D.①②③④⑤⑥
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年河南省高二上9月月考化学卷(解析版) 题型:选择题
当CH3COOH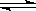 H++CH3COO﹣已达平衡,若要使醋酸的电离程度和溶液的pH都减小,应加入的试剂是(
H++CH3COO﹣已达平衡,若要使醋酸的电离程度和溶液的pH都减小,应加入的试剂是(  )
)
A.CH3COONa B.NH3•H2O C.HCl D.H2O
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上学期第一次月考化学试卷(解析版) 题型:推断题
I、通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答。
(1)用化学符号表示下列微粒:C:________,D:_________。
(2)写出A、B、E三种微粒反应的离子方程式:______________________。
II、A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物的化学式为AE,其分子中含18个电子。请回答下列问题:
(1)D元素的原子结构示意图为___________________。
(2)由A、B、C三种元素形成的化合物的电子式为_________________,这种化合物中所含的化学键类型有___________________。
(3)A2B的沸点高于A2D,其原因是______________________。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是_________________(用离子方程式表示);将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,则该过程的总化学反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
以a g KNO3溶于b g水,形成VmL饱和溶液。下列关系式错误的是( )
A.KNO3物质的量浓度: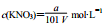
B.20℃时KNO3的溶解度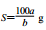
C.KNO3质量分数: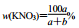
D.该溶液的密度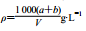
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期9月月考化学试卷(解析版) 题型:实验题
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等试验(图中夹持装置有省略)。请按要求填空:
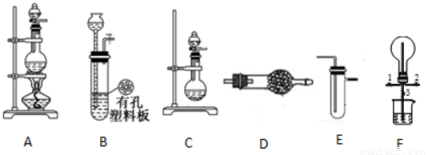
I.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与 (填装置编号)连接;装置C中的烧瓶内固体宜选用 。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是 。
(3)装置F可用于探究氯气与氨气(已知氯气与 氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开开关1、3,关闭2,先向烧瓶中通入 ,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子 。
Ⅱ.探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是 。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式 。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为 ;F的烧杯所起的作用是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学试卷(解析版) 题型:填空题
自来水厂生产自来水时,需要用到净水剂,对水进行消毒杀菌处理。
(1)漂白粉是常用的一种消毒剂,制备过程的化学方程式为 。漂白粉不能与家庭中常用的洁厕剂(一种酸性液体,主要含HCl)混合使用,否则容易造成人体中毒,其原因是(用有关的离子方程式表示) 。
(2)高铁酸钾(K2FeO4)是一种新型多功能水处理剂。工业上有多种方法制备高铁酸钾,其中一种方法是在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁。该反应可用离子方程式表示为 。
(3)用高铁酸钾和锌制成的高铁碱性电池,能储存比普通碱性电池多50%电能,已知该电池的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则负极的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学试卷(解析版) 题型:选择题
已知:①N2(g)+O2(g)=2NO(g) △H1=+180kJ·mol-1
②N2(g)+3H2(g) 2NH3(g) △H2=-92.4 kJ·mol-1
2NH3(g) △H2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6 kJ·mol-1

下列说法正确的是
A.反应②中的能量变化如图所示,则△H2=E1-E3
B.N2的燃烧热为180 kJ·mol-1
C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1molN2和3molH2,反应后放出的热量为Q1kJ,则Q1=92.4
D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-906 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第二次月考化学卷(解析版) 题型:选择题
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g) CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
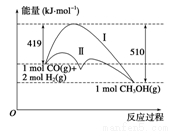
A.该反应的ΔH=+91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量小于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江牡丹江高级中学高二9月月考化学卷(解析版) 题型:选择题
合成氨反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图:下列说法正确的是
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图:下列说法正确的是

A.t1时升高了温度 B.t2时使用了催化剂 C.t3时增大了压强 D.t4时降低了温 度
度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com