
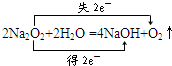 ,所以
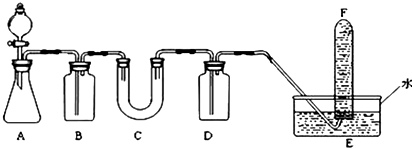
,所以分析 由实验装置可知,本实验首先由CaCO3和盐酸反应生成CO2,产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后过氧化钠与CO2和水气反应,产生O2,用排水法收集O2,最后取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气,
(1)A为由CaCO3和盐酸反应生成CO2;B的作用是除去二氧化碳中含有的氯化氢,应该为饱和碳酸氢钠溶液;
(2)根据分析可知,过氧化钠应该放在C装置中;根据检验氧气的方法分析;
(3)①阿龙哥加入酚酞,溶液变红后,振荡锥形瓶,见红色褪去,说明溶于水双氧水将酚酞氧化二褪色,而无双弟的滴入一两滴后,溶液就变成了红色,说明加热后双氧水分解,据此判断反应历程,然后写出Na218O2与CO2反应的化学方程式;
②无双弟将溶液加热后双氧水分解,消除了双氧水对中和滴定(特别是指示剂)的影响;由于酚酞能够消耗强氧化钠溶液,导致滴定结果偏低;
③无双弟的操作合理,测定结果较准确,根据中和滴定原理及滴定数据计算出该样品中过氧化钠的纯度;
(4)设过氧化钠为2mol、硫酸亚铁为3mol,根据化合价变化判断过量情况,然后根据判断结果计算出反应产物组成,最后写出反应的离子方程式;
(5)Kw表示的是氢离子与氢氧根离子的浓度之积,不是水的电离平衡常数.
解答 解:由实验装置可知,本实验首先由CaCO3和盐酸反应生成CO2,产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后过氧化钠与CO2和水气反应,产生O2,用排水法收集O2,最后取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气,
(1)A为由CaCO3和盐酸反应生成CO2,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,所以A的作用是制取CO2气体;
盐酸具有挥发性,制取的二氧化碳中混有氯化氢,会影响实验测定,应该用饱和碳酸氢钠溶液除去,则B中盛放的是饱和Na2HCO3溶液,
故答案为:制取CO2气体;饱和Na2HCO3溶液;
(2)过氧化钠应该分子C装置中,能说明它可做潜艇供氧剂的实验操作及现象为:待F集满气体后,用大拇指堵住管口从水槽中取出正立,松开拇指后,将带火星的木条迅速伸到试管口,若木条复燃,则说明过氧化钠与二氧化碳反应产生氧气,可作供氧剂,
故答案为:C; 待F集满气体后,用大拇指堵住管口从水槽中取出正立,松开拇指后,将带火星的木条迅速伸到试管口,若木条复燃,则说明过氧化钠与二氧化碳反应产生氧气,可作供氧剂;
(3)①滴定时阿龙哥加入酚酞,溶液变红后,振荡锥形瓶,见红色褪去,说明溶于水双氧水将酚酞氧化二褪色,而无双弟的滴入一两滴后,溶液就变成了红色,说明加热后双氧水分解,据此可知反应历程为:①Na${\;}_{2}^{18}$O2+2H-OH═2NaOH+H${\;}_{2}^{18}$O2;②2H${\;}_{2}^{18}$O2═2H${\;}_{2}^{18}$O,即:无双弟的说法正确;据无双弟的反应历程可知,Na218O2与CO2反应的化学方程式为:2Na218O2+2CO2+2H2O=2Na2CO3+2H218O+18O2↑,
故答案为:无双弟; 2Na218O2+2CO2+2H2O=2Na2CO3+2H218O+18O2↑;
②由于沸水能使Na2O2溶解时所生成的H2O2迅速分解,消除了双氧水对中和滴定(特别是指示剂)的影响,所以无双弟的操作方法正确;另一个同学加入了较多酚酞,酚酞能够消耗强氧化钠溶液,则滴定过程中消耗盐酸的体积偏小,测定结果偏小,
故答案为:无双弟;沸水能使Na2O2溶解时所生成的H2O2迅速分解,消除其对中和滴定(特别是指示剂)的影响;偏小;
③无双弟的操作合理,若100mL配制的样品溶液完全用该浓度的盐酸中和,消耗盐酸体积应该为:VWmL×$\frac{100mL}{20mL}$=5VWmL,消耗氯化氢的物质的量为:cmol/L×5VW×10-3L=5cVW×10-3mol,则样品中含有强氧化钠的物质的量为:5cVW×10-3mol,过氧化钠的物质的量为:$\frac{1}{2}$×5cVW×10-3mol=2.5cVW×10-3mol,
样品的纯度为:$\frac{78g/mol×2.5c{V}_{W}×1{0}^{-3}L}{ag}$×100%=$\frac{19.5c{V}_{w}}{a}$%,
故答案为:$\frac{19.5c{V}_{w}}{a}$%;
(4)设过氧化钠为2mol,则硫酸亚铁为3mol,2mol过氧化钠完全反应能够得到4mol电子,3mol亚铁离子完全被氧化成铁离子失去3mol电子,显然过氧化钠过量,根据电子守恒3mol亚铁离子完全反应消耗过氧化钠的物质的量为为:$\frac{3mol×(3-2)}{2}$=1.5mol,剩余的0.5mol过氧化钠与水反应生成1mol氢氧化钠和0.25mol氧气,反应后溶质为硫酸钠和硫酸铁,其中硫酸钠的物质的量为2mol,则硫酸铁的物质的量为:$\frac{1}{3}$×(3mol-2mol)=$\frac{1}{3}$mol,$\frac{1}{3}$mol硫酸铁中含有$\frac{2}{3}$mol铁离子,
生成氢氧化铁的物质的量为:3mol-$\frac{2}{3}$mol=$\frac{7}{3}$mol,据此写出反应的离子方程式为:24Na2O2+36Fe2++42H2O=48Na++28Fe(OH)3↓+8Fe3++3O2↑,
故答案为:24Na2O2+36Fe2++42H2O=48Na++28Fe(OH)3↓+8Fe3++3O2↑;
(5)水的电离平衡为:H2O=H++OH-,则水的电离平衡常数K=[c(H+)•c(OH-)]/c(H2O),而Kw=c(H+)•c(OH-),易知Kw=K c(H2O),所以Kw不是水的电离平衡常数,而是水的电离平衡常数与水的浓度的乘积值,
故答案为:不是;由于H2O=H++OH-,故水的电离平衡常数K=[c(H+)•c(OH-)]/c(H2O),而Kw=c(H+)•c(OH-),易知Kw=K c(H2O),所以Kw不是水的电离平衡常数,而是水的电离平衡常数与水的浓度的乘积值.
点评 本题考查了物质性质实验方案的设计,题目难度较大,明确过氧化钠与水反应的实质为解答关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学计算、化学实验能力,(4)为难点、易错点,需要正确判断反应产物.


科目:高中化学 来源: 题型:选择题
| A. | C02分子比例模型示意图: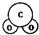 | B. | O原子核外电子轨道表示式: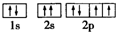 | ||
| C. | Ca2+电子排布式:ls22s23s23p6 | D. | K原子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
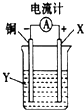
| A. | X可以是银或石墨 | B. | Y是硫酸铜溶液 | ||
| C. | 电子从铜电极经外电路流向X电极 | D. | X极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④① | C. | ④③②① | D. | ②③①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
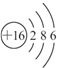 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com