
【题目】向50mLbmol/L的AlCl3溶液中加入50mLamol/L的NaOH溶液。
(1)当a、b关系不同时,反应所生成沉淀的质量不同。填写下表:___
a与b的关系 | 生成沉淀的质量(g) |
(2)若b=1mol/L时,要生成沉淀3.12g,则a值等于多少___?
【答案】
a与b的关系 | 生成沉淀的质量(g) |
a≤3b | 1.3a |
4b>a>3b | 15.6b-3.9a |
a≥4b | 0 |
2.4或3.2
【解析】
50mLbmol/L的AlCl3的物质的量为50×10-3L×bmol/L=0.05 bmol, 50mLamol/L的NaOH溶液物质的量为50×10-3L×amol/L=0.05 amol。
AlCl3和NaOH溶液反应可能生成Al(OH)3或NaAlO2,AlCl3溶液中加入NaOH溶液的反应过程为:AlCl3+3NaOH=Al(OH)3↓,Al(OH)3+NaOH= NaAlO2+2H2O,总反应:AlCl3+4NaOH= NaAlO2+2H2O。可在此基础上进行讨论。
(1)根据反应AlCl3+3NaOH=Al(OH)3↓,AlCl3过量和恰好完全生成Al(OH)3时,NaOH全部用于生成沉淀,关系为:0.05bmol×3≥0.05amol,a≤3b,生成的沉淀质量为0.05amol×![]() ×78gmol-1=1.3ag;根据反应AlCl3+4NaOH= NaAlO2+2H2O,恰好完全生成NaAlO2 和NaOH过量时,关系为:0.05bmol×4=0.05amol,a≥4b,此时无沉淀;当4b>a>3b 时,分两步计算:
×78gmol-1=1.3ag;根据反应AlCl3+4NaOH= NaAlO2+2H2O,恰好完全生成NaAlO2 和NaOH过量时,关系为:0.05bmol×4=0.05amol,a≥4b,此时无沉淀;当4b>a>3b 时,分两步计算:
第一步,AlCl3完全沉淀,生成Al(OH)30.05bmol,消耗NaOH0.05bmol×3=0.15bmol;第二步,沉淀部分溶解:

n=(0.05a-0.15b)mol
则未溶的沉淀质量为:[0.05bmol-(0.05a-0.15b)mol]×78gmol-1=(15.6b-3.9a)g。
综上所述,当a、b关系不同时,反应所生成沉淀的质量如下表:
a与b的关系 | 生成沉淀的质量(g) |
a≤3b | 1.3a |
4b>a>3b | 15.6b-3.9a |
a≥4b | 0 |
答案为:
a与b的关系 | 生成沉淀的质量(g) |
a≤3b | 1.3a |
4b>a>3b | 15.6b-3.9a |
a≥4b | 0 |
(2) 若b=1mol/L时,a=要生成沉淀3.12g讨论如下:
a≤3b=3时,1.3a=3.12,a=2.4<3,答案合理;4b>a>3b即4>a>3时,15.6b-3.9a=15.6-3.9a=3.12,a=3.2,4>3.2>3,答案合理。
答案为:2.4或3.2


科目:高中化学 来源: 题型:
【题目】按照下列元素基态原子的电子排布特征判断元素,并回答问题:
A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)以下分别是哪种元素(用元素符号填空):
A:_____________;C:_____________;D:____________;
(2)B原子的核外电子排布式_____________;写出A的负一价阴离子的电子式_____________。
(3)E的原子结构示意图_____________。
(4)写出由A、C两元素形成的18e-分子的形成过程:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:
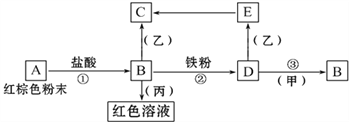
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。刻蚀印刷电路板涉及的离子方程式为________,检验溶液中还有Fe3+的试剂是_________。
(2)—定量的SO2与NaOH溶液反应,所得产物中含有Na2SO3和NaHSO3,物质的量之比为3:5,则参加反应的SO2与NaOH的物质的量之比为___________。
(3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为_________。
(4)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中 CO和CO2物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用乙醚、95%乙醇浸泡杜仲干叶,得到提取液,进步获得绿原酸粗产品的种工艺流程如下,下列说法错误的是
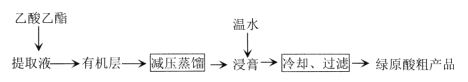
A.常温下,绿原酸易溶于水
B.浸膏的主要成分是绿原酸
C.减压蒸馏的目的是降低蒸馏温度,以免绿原酸变质
D.绿原酸粗产品可以通过重结晶进一步提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】增塑剂DCHP可由环己醇制得。DCHP和环己醇的结构简式如图所示,下列说法错误的是( )
![]()
环己醇
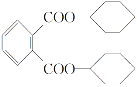
DCHP
A. DCHP的分子式为C20H26O4
B. 环己醇分子中所有碳原子不可能共平面
C. DCHP的一氯取代物有5种
D. DCHP通过取代反应可以得到环己醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。
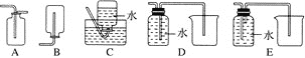
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图的说法不正确的是( )

A. 1mol固态碘与![]() 化合生成2molHI气体时,需要吸收5kJ的能量
化合生成2molHI气体时,需要吸收5kJ的能量
B. 2molHI气体分解生成1mol碘蒸气与![]() 时需要吸收12kJ的能量
时需要吸收12kJ的能量
C. 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量
D. 碘蒸气与![]() 生成HI气体的反应是吸热反应
生成HI气体的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用碳酸钠晶体(Na2CO3·10H2O)来配制0.5 mol·L-1的Na2CO3溶液1 000 mL,假如其他操作均是正确无误的,下列情况会引起配制溶液的浓度偏高的是( )
A. 称取碳酸钠晶体100 g
B. 定容时,俯视观察刻度线
C. 移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗
D. 定容后,将容量瓶振荡均匀,静置时发现液面低于刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com