

| A. | 图甲:进行中和热的测定 | |
| B. | 图乙:比较 HCl、H2CO3和 H2SiO3 的酸性强弱 | |
| C. | 图丙:验证 CuCl2对 H2O2 分解有催化作用 | |
| D. | 图丁:验证 2NO2(g)?N2O4(g)△H<0 |
分析 A.铜丝可导电,导致热量散失;
B.盐酸易挥发,盐酸与硅酸钠溶液反应;
C.温度不同、催化剂不同;
D.温度不同,温度高时颜色深.
解答 解:A.铜丝可导电,导致热量散失,应选环形玻璃搅拌棒,故A错误;
B.盐酸易挥发,盐酸与硅酸钠溶液反应,则不能比较H2CO3和 H2SiO3 的酸性强弱,故B错误;
C.温度不同、催化剂不同,应控制温度相同,探究催化剂对反应速率的影响,故C错误;
D.温度不同,温度高时颜色深,则可验证 2NO2(g)?N2O4(g)△H<0,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握中和热测定、酸性比较、影响反应速率及平衡的因素为解答的关键,侧重分析与实验能力的考查,注意化学反应原理与实验的结合,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHS水解反应:HS-+H2O═H3O++S2- | |
| B. | 1mol的Cl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 | |
| C. | 碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O | |
| D. | 向NaAlO2溶液中加入碳酸氢钠:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(l);|△H|>297.3kJ/mol | |
| B. | S(g)+O2(g)=SO2(l);|△H|<297.3kJ/mol | |
| C. | 1mol SO2的键能总和小于1mol S和1mol O2键能之和 | |
| D. | 1mol SO2的具有的能量等于1mol S和1mol O2具有的能量之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
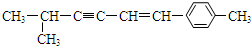 ,下列说法中正确的是( )
,下列说法中正确的是( )| A. | 该分子中所有的碳原子均可能处于同一平面上 | |
| B. | 该分子中一定共面的碳原子数至少为8个 | |
| C. | 该分子中至少有9个碳原子处于同一条直线上 | |
| D. | 该分子中可能共面的碳原子数最多为13个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
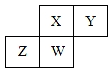 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性:X>W>Z | |
| C. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| D. | ZY2晶体熔化、液态Y3气化均需克服分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
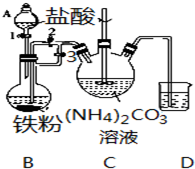 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com