
| 实验 | 电极甲 | 电极乙 |
| I | Zn | Cu |
| II | Al | Cu |
科目:高中化学 来源:不详 题型:单选题

| A.电池放电时Na+从a极区移向b极区 |
| B.每消耗3mol H2O2,转移的电子为3mol |
| C.该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
| D.电极b采用MnO2,MnO2既作电极材料又有催化作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.I2在石墨上被还原 |
| B.石墨电极为负极,银电极为正极 |
| C.Ag+从负极向正极移动 |
| D.银电极的电极反应是:Ag - e— =Ag+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
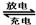 Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )
Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )| A.放电时,Cd作负极 |
| B.放电时,NiO(OH)作负极 |
| C.电解质溶液为碱性溶液 |
| D.放电时,负极反应为Cd+2OH--2e-=Cd(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| 选项 | 电极a | 电极b | A溶液 | B溶液 | 现象或结论 |
| A | Cu | Zn | CuSO4 | ZnSO4 | 一段时间后,a增加的质量与b减少的质量相等 |
| B | Cu | Zn | 稀H2SO4 | ZnSO4 | 盐桥中阳离子向b极移动 |
| C | C | C | FeCl3 | KI、淀粉混 合液 | b极附近溶液变蓝 |
| D | Fe | C | NaCl | FeCl3 | 外电路电子转移方向:b→a |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
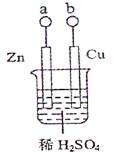
| A.a、b不连接时,只有锌片上有气泡逸出 |
| B.a和b用导线连接时,铜片上发生的反应为:2H+ + 2e-=H2 ↑ |
| C.a和b是否用导线连接,装置中所涉及的化学反应都相同 |
| D.a和b用导线连接或接直流电源,锌片都能溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
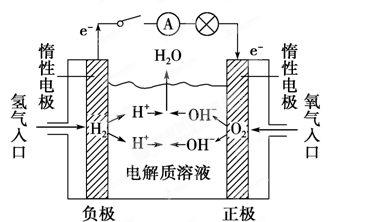
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
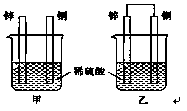
| A.装置甲、乙中铜片表面均无气泡产生 |
| B.装置甲、乙中稀硫酸的浓度均减小 |
| C.装置乙中锌片是正极,铜片是负极 |
| D.装置乙中产生气泡的速率比装置甲快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

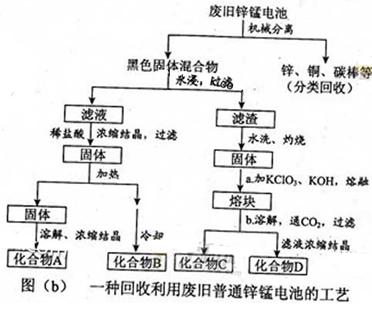
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com