
| A. | 标准状况下,22.4LSO3中含有氧原子的数目为3NA | |
| B. | 18gH218O 中含有的电子数为10NA | |
| C. | 常温下,4g甲烷中含有C-H键的数目为NA | |
| D. | 24g镁原子最外层电子数为NA |
分析 A、标况下三氧化硫为固体;
B、H218O的摩尔质量为20g/mol,且含10个电子;
C、求出甲烷的物质的量,然后根据1mol甲烷中含4molC-H 键来分析;
D、求出镁的物质的量,然后根据镁的最外层有2个电子来分析.
解答 解:A、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和含有的氧原子个数,故A错误;
B、H218O的摩尔质量为20g/mol,故18gH218O的物质的量为0.9mol,且H218O中10个电子,故0.9molH218O中含9NA个电子,故B错误;
C、4g甲烷的物质的量为0.25mol,而1mol甲烷中含4molC-H 键,故0.25mol甲烷中含NA条C-H键,故C正确;
D、24g镁的物质的量为1mol,而镁的最外层有2个电子,故1mol镁的最外层电子数为2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 两种溶液的pH相同 | |
| B. | NH3•H2O的电离方程式:NH3•H2O=NH4++OH- | |
| C. | 分别与等物质的量浓度、等体积的盐酸混合后,所得溶液都显中性 | |
| D. | 等体积的两溶液与硫酸完全反应,消耗硫酸的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
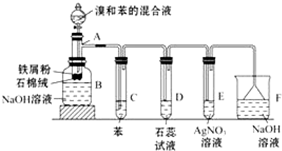 图为苯和溴的取代反应的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉.
图为苯和溴的取代反应的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界里Na元素只以化合态存在 | |
| B. | 钠与水反应放出氧气 | |
| C. | 钠放置在空气中很快被氧化为白色Na2O2 | |
| D. | 钠投入稀CuSO4溶液中,可置换出金属Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L溶液中含有4g NaOH | B. | 1L水中溶解4gNaOH | ||
| C. | 0.5L溶液中含有0.2mol H2SO4 | D. | 9.8g H2SO4溶于1L水配成溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400ρmol•L-1 | B. | 20ρmol•L-1 | C. | 2.5ρmol•L-1 | D. | 1.25ρmol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com