
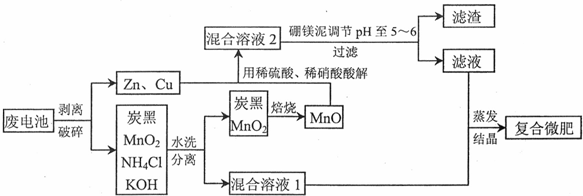
分析 废电池剥离破碎分离为锌、铜金属和炭黑、MnO2、NH4Cl、KOH,其中炭黑、MnO2、NH4Cl、KOH水洗过滤得到滤渣炭黑、MnO2,滤液混合溶液Ⅰ为NH4Cl、KOH水溶液反应后得到一水合氨和氯化钾,Zn、Cu、MnO被稀硫酸和稀硝酸溶解得到混合溶液Ⅱ,Mn02不溶于硫酸和硝酸,MnO可溶于酸,所以溶液中含有Zn2+、Cu2+、Mn2+,加入硼镁泥中含MgO,Na2B407,MnO,Fe203,Si02,CaO等化合物来调节溶液PH=5-6,有H3B03沉淀生成,过滤得到滤液和混合溶液Ⅰ混合,通过蒸发浓缩,冷却结晶,过滤洗涤得到复合微肥;
(1)复合微肥的成分为滤液混合溶液Ⅰ为NH4Cl、KOH水溶液反应后得到一水合氨和氯化钾,和滤液混合含有农作物生长必需的多种微量元素外,还含有必需的大量元素氮和钾元素;
(2)焙烧时反应为二氧化锰和碳发生氧化还原反应,生成MnO可溶于酸;
(3)酸解过程中是锌、铜在稀硝酸溶液中被氧化,稀硝酸被还原为NO,一氧化氮和空气混合溶于水可以重新生成稀硝酸,酸解后的溶液加入硼镁泥调节溶液pH时,有H3B03沉淀生成,是Na2B407和酸反应生成;PH=6,c(OH-)=10-8mol/L,依据溶度积常数计算沉淀所需要的锰离子浓度分析判断,氢氧化镁和氢氧化锰阴离子和阳离子组成比相同,可以利用溶度积常数大小比较溶解度大小;
(4)依据锰元素守恒,结合离子方程式定量关系计算得到;
(5)选用废玻璃、粉煤灰、炼钢炉渣和矿石等为原料高温烧制,将熔融物冷水淬冷成块,再磨成细粉即得玻璃微肥,减少溶解避免流失.
解答 解:废电池剥离破碎分离为锌、铜金属和炭黑、MnO2、NH4Cl、KOH,其中炭黑、MnO2、NH4Cl、KOH水洗过滤得到滤渣炭黑、MnO2,滤液混合溶液Ⅰ为NH4Cl、KOH水溶液反应后得到一水合氨和氯化钾,Zn、Cu、MnO被稀硫酸和稀硝酸溶解得到混合溶液Ⅱ,Mn02不溶于硫酸和硝酸,MnO可溶于酸,所以溶液中含有Zn2+、Cu2+、Mn2+,加入硼镁泥中含MgO,Na2B407,MnO,Fe203,Si02,CaO等化合物来调节溶液PH=5-6,有H3B03沉淀生成,过滤得到滤液和混合溶液Ⅰ混合,通过蒸发浓缩,冷却结晶,过滤洗涤得到复合微肥;
(1)复合微肥的成分为滤液混合溶液Ⅰ为NH4Cl、KOH水溶液反应后得到一水合氨和氯化钾,和滤液混合含有农作物生长必需的多种微量元素外,还含有必需的大量元素氮和钾元素;
故答案为:钾;
(2)Mn02不溶于硫酸和硝酸,焙烧时反应为二氧化锰和碳发生氧化还原反应,生成MnO可溶于酸,反应的化学方程式为:MnO2+C$\frac{\underline{\;\;△\;\;}}{\;}$MnO+CO↑,焙烧目的是将不溶于酸的MnO2转化为可溶于酸的MnO,
故答案为:MnO2+C$\frac{\underline{\;\;△\;\;}}{\;}$MnO+CO↑;将不溶于酸的MnO2转化为可溶于酸的MnO;
(3)酸解过程中是锌、铜在稀硝酸溶液中被氧化,稀硝酸被还原为NO,一氧化氮和空气混合溶于水可以重新生成稀硝酸,可循环利用,酸解后的溶液加入硼镁泥调节溶液pH时,有H3B03沉淀生成,是Na2B407和酸反应生成,反应的离子方程式为:B4O72-+2H++5H2O=4H3BO3↓,PH=6,c(OH-)=10-8mol/L,依据溶度积常数计算沉淀所需要的锰离子浓度,若析出Mn(OH)2沉淀,所需c(Mn2+)的最小值为$\frac{1.9×1{0}^{-13}}{(1×1{0}^{-8})^{2}}$=1900mol/L,c(Mn2+)不可能达到此数值,故不能析出Mn(OH)2沉淀,氢氧化镁和氢氧化锰阴离子和阳离子组成比相同,可以利用溶度积常数大小比较溶解度大小,由于Ksp(Mn(OH)2)<Ksp(Mg(OH)2),所以Mn(OH)2也不可能析出,
故答案为:NO;B4O72-+2H++5H2O=4H3BO3↓;PH=6,c(OH-)=10-8mol/L,若析出Mn(OH)2沉淀,所需c(Mn2+)的最小值为$\frac{1.9×1{0}^{-13}}{(1×1{0}^{-8})^{2}}$=1900mol/L,c(Mn2+)不可能达到此数值,故不能析出Mn(OH)2沉淀,由于Ksp(Mn(OH)2)<Ksp(Mg(OH)2),所以Mn(OH)2也不可能析出;
(4)依据锰元素守恒,结合离子方程式定量关系计算,发生反应Mn2++ClO-+H2O═MnO2↓+2H++Cl-,n(MnO2)=n(Mn)=$\frac{bg}{87g/mol}$=$\frac{b}{87}$mol,则产品中锰元素的质量分数=$\frac{\frac{b}{87}mol×55g/mol}{ag}$×100%=$\frac{55b}{87a}$×100%,
故答案为:$\frac{55b}{87a}$×100%;
(5)玻璃可微量溶于水,选用废玻璃、粉煤灰、炼钢炉渣和矿石等为原料高温烧制,将熔融物冷水淬冷成块,再磨成细粉即得玻璃微肥,减少溶解避免流失,玻璃微肥具有的优点是肥分缓释,肥分时间长或不易被雨水淋失或不污染环境,
故答案为:肥分缓释,肥分时间长或不易被雨水淋失或不污染环境.
点评 本题考查了物质分离和提纯的分析判断,主要是反应条件,物质性质的理解应用,沉淀溶解平衡,溶度积常数的计算应用,掌握基础是关键,题目难度中等.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3的稳定性介于Na2CO3•10H2O和NaHCO3之间 | |
| B. | “侯氏制碱法”制得的碱是指NaHCO3 | |
| C. | 可用盐酸鉴别Na2CO3 和NaHCO3固体 | |
| D. | 纯碱有时可代替烧碱使用,比如溶解石英、吸收氯气等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 卤素的单质及其化合物在生产、生活中应用广泛.
卤素的单质及其化合物在生产、生活中应用广泛. (如${\;}_{1}^{2}$H).
(如${\;}_{1}^{2}$H).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液中c(Ag+)•c(Cl-)>Ksp(AgCl) | |
| B. | 上述实验说明Cl-与NH4+间有很强的结合力 | |
| C. | 所得溶液中形成了难电离的物质 | |
| D. | 上述过程中NH3•H2O的电离常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍的氧化物对应的水化物可能具有两性 | |
| B. | 砹是一种有色固体,HAt很不稳定,AgAt是有色难溶于水的固体 | |
| C. | 高溴酸(HBrO4)的酸性比硒酸(H2SeO4)的酸性弱 | |
| D. | 硫酸锶(SrSO4)是难溶于水和盐酸的白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯 | B. | 乙炔 | C. | 丙烯 | D. | 丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑧⑨ | B. | ①③⑥⑦⑨ | C. | ①③⑤⑥⑦ | D. | ①②③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )
重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )| A. | 电解时惰性电极应与直流电源的负极相连 | |
| B. | 通电后阴极室产生的现象为:产生无色气体,溶液由无色变黄色 | |
| C. | 制备过程中总的离子方程式为:2CrO42-+3H2O=Cr2O72-+2OH-+2H2↑+O2↑ | |
| D. | 若实验开始时在右室中加入38.8克的K2CrO4,tmin后测得右室中K与Cr的物质的量之比为3:2,此时电路中转移电子的物质的量为0.1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com